2011-2012学年度第二学期期末考试
2015-10-20 17:10:33 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
2011-2012学年度第二学期期末考试
高一化学试题
注意事项:
1.答题之前,考生务必将自己的姓名、考号、座位号写在答题纸密封线内。
2.第I卷选择题的答案必须填在答题纸的表格内,写在其它位置上的选择题答案无效;第Ⅱ卷的答案直接写在题中留的空白处。
可能用到的相对原子质量:H—1 O—16 C—12 Na—23 Mg—24 Al—27 Ca—40 S—32
第I卷 (选择题 共50分)
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
1.据报导,我国科学家最近合成了多种新核素,其中一种是![]() (铪),下列有关该同位素的叙述正确的是
(铪),下列有关该同位素的叙述正确的是
A.该核素的质量数为72 B.该核素的质子数为185
C.该核素的中子数为113 D.该核素的核外电子数为113
2. 唐代伟大诗人李商隐在一首名为《无题》的诗中有一句名句是:“春蚕到死丝方尽,蜡炬成灰泪始干。”诗句中“丝”和“泪”的主要成分分别属于
A、纤维素、脂肪 B、淀粉、油脂
C、蛋白质、烃 D、蛋白质、水
3.下列关于糖类的说法正确的是
A.所有糖类物质都有甜味,但不一定都溶于水
B.葡萄糖和果糖结构和性质不同,但分子式相同,它们是同分异构体
C.淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖,所以它们是同分异构体
D.葡萄糖和蔗糖不是同分异构体,但属于同系物
4.已知115号元素的原子有七个电子层,最外层有5个电子,试判断115号元素在元素周期表中的位置是
A.第七周期第IIIA族 B.第七周期第VA族
C.第五周期第VIIA族 D.第五周期第IIIA族
5. 下列说法正确的是
A、乙醇在铜做催化剂的条件下,可以被氧气氧化为乙醛
B、糖类、油脂、蛋白质都是由C、H、O三种元素组成的
C、酸雨的形成主要是由于大气中二氧化碳含量增大引起的
D、葡萄糖、蔗糖和淀粉均可以与新制的氢氧化铜或银氨溶液发生反应生成沉淀
6.关于离子键、共价键的各种叙述中,下列说法中正确的是
A.在离子化合物里,只存在离子键,没有共价键
B.非极性键只存在于单质分子中
C.由不同种元素组成的含多个原子的分子里,一定只存在极性键
D.原子序数为11和17的元素能形成离子化合物,该化合物中只存在离子键,不存在共价键
7.下列关于原电池的说法中,正确的是
A.原电池是利用氧化还原反应将化学能转换为电能的装置
B.由于生铁中含碳,所以生铁比纯铁不容易腐蚀
C.在原电池中,电子从正极流向负极
D.在原电池中,负极上发生还原反应,正极上发生氧化反应
 |
8.下列化学用语表示正确的是
A.四氯化碳的电子式:![]() B.硫离子结构示意图:
B.硫离子结构示意图:
C.乙烷的结构简式:CH3CH3 D.苯分子的最简式为:C6H6
9.某短周期元素X的气态氢化物和最高价氧化物的对应的水化物可以发生反应生成一种盐,则X的最高氧化物的水化物的化学式为
A. HXO B. HXO3 C. HXO4 D. H2XO4
10.镭是元素周期表中第七周期第IIA族元素,关于其叙述不正确的是
A.镭的金属性比钙弱 B.单质能与水剧烈反应生成H2
C.在化合物中呈+2价 D.碳酸镭难溶于水
11.下列关于F、Cl、Br、I性质的比较,正确的是
A、随核电荷数的增加,最高价氧化物对应的水化物酸性逐渐增强
B、随核电荷数的增加,它们单质的氧化性增强
C、随核电荷数的增加,它们的原子半径逐渐增大
D、随核电荷数的增加,它们原子的最外层电子数递增
12.下列关于物质性质变化的比较,不正确的是
A.原子半径大小: Na > S > O
B.离子半径: F-<Na+<Mg2+<Al3+
C.气态氢化物稳定性: HBr < HCl < HF
D.碱性强弱: KOH > NaOH > LiOH
13.已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式正确的是
A、a=b+m+n B、a=b-m+n C、a=b+m-n D、a=b-m-n
14.下列关于化学反应中能量变化的说法正确的是
A、若化学反应中断键所放出的热量大于成键所吸收的能量,一定是放热反应
B、若化学反应中反应物的总能量大于生成物的总能量,一定是放热反应
C、化学反应中能量变化的大小与反应物的量的多少无关
D、化学反应中不一定有能量变化
15. 某有机物在氧气中充分燃烧生成水和二氧化碳的物质的量比为1:1,下列判断正确的是
A.该有机物分子中碳、氢原子个数比为1︰2
B.该有机物的最简式是CH2,肯定是乙烯的同系物
C.该有机物分子中碳、氢、氧原子个数比为1︰2︰3
D.该有机物肯定是烃的衍生物
16.氢气在氯气中燃烧产生苍白色火焰,并放出大量的热量。在反应过程中,破坏1 mol 氢气中的化学键消耗的能量为Q1kJ,破坏1 mol 氯气中的化学键消耗的能量为Q2KJ,形成1 mol 氯化氢中的化学键释放的能量为Q3kJ。下列关系式中正确的是
A.Q1 + Q2 >Q3 B.Q1 + Q2 <2Q3
C. Q1 + Q2 <Q3 D.Q1 + Q2 >2Q3
17、下列用水就能鉴别的一组物质是
A.苯、己烷、四氯化碳 B.硝基苯、乙醇、乙酸
C.硝基苯、乙醇、四氯化碳 D. 苯、乙醇、四氯化碳
18.下列化学反应中,不符合金属冶炼基本原理的要求的是:
高温
A、2NaCl(熔融)
![]() 2Na + Cl2↑
2Na + Cl2↑
B、Al2O3 + 2Fe ===== 2Al + Fe2O3
C、Fe2O3 + 3CO ![]() 2Fe + 3CO2↑
2Fe + 3CO2↑
D、2Ag2O ![]() 4Ag + O2↑
4Ag + O2↑
19. 某有机物的结构为
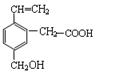
这种有机物不可能具有的性质是
A.能跟NaOH溶液反应 B.能使酸性KMnO4溶液褪色
C.能发生酯化反应 D.能发生水解反应
20.对于A + 3B![]() 2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是
2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是
A. v(A) =0.4mol/(L•s) B. v(B) =0.9mol/(L•s)
C.v(C) =0.6mol/(L•s) D. v(D) =4.2mol/(L•min)
21. 一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)在容积一定的密闭容器中达到化学平衡状态的标志是
2NH3(g)在容积一定的密闭容器中达到化学平衡状态的标志是
A.N2、H2和NH3的物质的量分数不再改变
B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C.混合气体的密度不再发生变化
D.单位时间里每消耗1molN2,同时生成2molNH3
22. 下图为氢氧燃料电池原理示意图,所用的氢氧燃料电池的电极应为:
负极:2H2+4OH--4e-=4H2O 正极 O2+2H2O+4e-=4OH-

该电池工作时,下列叙述正确的是
A.氢气发生还原反应,氧气发生氧化反应
B.每转移4摩电子,电池内增加4摩水
C.电池工作时负极附近溶液的PH值降低
D. 电池工作时正极附近H+浓度增大
23、等质量的下列烃,分别完全燃烧时,消耗O2质量最多的是
A.CH4 B.C6H6 C.C2H4 D.C7H8
24.有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为:
A.A>B>C>D B.C>A>B>D C.A>C>D>B D.B>D>C>A
25.结合甲烷、乙烯和苯的空间结构分析,关于下面有机物的空间结构的判断正确的是
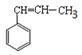
A.该有机物中所有原子有可能共平面
B.该有机物中所有碳原子有可能共平面
C.该有机物中最多有8个碳原子共平面
D.该有机物中所有碳原子一定共平面
2011-2012年第二学期期末考试
高一化学试题
第Ⅰ卷 (选择题 共50分)
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
题号 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
|
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷 (非选择题 共50分)
二、填空题(本题包括3小题,共20分)
26.(4分)下面列出了几组物质,请按要求将序号填写在空格上。
① 金刚石与石墨 ; ②16O、17O和18O;③氧气(O2)与臭氧(O3); ④ CH4和CH3CH2CH3; ⑤CH2= CH2和CH3CH3;⑥H2O和D2O

![]()
![]()
![]() ⑦
⑦
和 ;⑧ 和
(1)同位素: ,(2)同系物: ,
(3)同素异形体: ,(4)同分异构体: 。
![]() 27.(6分)A、B、C、D 四种短周期元素,原子序数依次增大,A原子的L层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D原子的L层电子数等于K、M两个电子层上电子数之和。
27.(6分)A、B、C、D 四种短周期元素,原子序数依次增大,A原子的L层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D原子的L层电子数等于K、M两个电子层上电子数之和。
![]() (1)A元素的名称为 ;
(1)A元素的名称为 ;
(2)A和B原子形成的原子个数比为1:2的化合物的电子式为 ;
(3)![]() C元素位于元素周期表中第 周期、第 族;
C元素位于元素周期表中第 周期、第 族;
(4)![]() D的最高价氧化物对应的水化物化学式为: ;
D的最高价氧化物对应的水化物化学式为: ;
![]() (5)用电子式表示C、D两元素化合物的形成过程 。
(5)用电子式表示C、D两元素化合物的形成过程 。
28.(10分)已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
 |
请回答下列问题:
(1)写出A的结构简式 ;D的官能团名称是 ;E物质的名称是 。
(2)指出反应类型:① ;② ;④ 。
(3)写出下列反应的化学方程式:
② ;
④ 。
三、实验探究题(本题包括3小题,共 20分)
29.(4分)将一螺旋状的铜丝放在酒精灯上灼烧,铜丝表面的颜色变为_____,立即将热的铜丝插入盛有乙醇的试管中,铜丝的表面颜色变为_______,试管内有__________气味产生,铜在该反应中起________作用。
30.(8分)某探究性学习小组,为了探究原电池的原理,他们利用实验室提供的以下材料进行探究实验,请根据题目要求回答相关问题:
实验材料:铜片、铁片、铝片、石墨棒、稀硫酸、电流计、烧杯、导线若干。
(1)若某同学选择用石墨棒做电极,则石墨棒做原电池的 极,应选择 做原电池的 极。该电池工作时,在石墨棒上看到的现象是:
;电极反应是: 。
(2)若另一名同学想用铁片做电池的正极,则负极应选择 , 原因是: ,原电池的总反应为: (写离子方程式)。
31.(8分)某液态有机物的结构简式为:HOOC—CH=CH—CH2OH,请你写出该有机物的分子式: ,该有机物的官能团有 种。化学老师要求化学兴趣小组的学生利用实验验证该有机物中含有的官能团,要求方法简单可行,现象明显,结论可靠。某同学设计了部分实验方案,假若你是其中一员,请你利用所学知识完成方案,在表中写出检验试剂、检验方法和实验现象。
|
官能团 |
检验试剂 |
实验方法 |
实验现象 |
|
—OH |
Na、NaOH固体(或其它碱性固体干燥剂) |
取少许样品,加入足量NaOH固体,与羧基充分反应后,再加入金属钠观察是否有气体放出。 |
有气体放出 |
|
—C=C— |
|
|
|
|
—COOH |
|
|
|
四、计算题(10分)
32.(4分)现有2.24L某气态烃A在氧气中充分燃烧,将产生的气体通过浓硫酸吸收后,浓硫酸增重9.0g,将气体通入足量石灰水中,石灰水增重17.6g。请同学们通过计算解决下列问题:
①写出气态烃A的分子式。
②写出该烃可能的结构简式。
33.(6分)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应3A(g)+B(g)![]() xC(g)+2D(g),经过4min时,测得A的浓度为0.5 mol/L,D的浓度为0.5 mol/L,C的反应速率是0.125 mol·L-1·min-1,
xC(g)+2D(g),经过4min时,测得A的浓度为0.5 mol/L,D的浓度为0.5 mol/L,C的反应速率是0.125 mol·L-1·min-1,
求:(1)x的值;(2)A在开始时的浓度;(3)B的转化率。
