2011-2012学年度第二学期高一年级化学竞赛试题
2015-10-20 17:00:25 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
西安市第八十九中学
2011-2012学年度第二学期高一年级化学竞赛试题
命题人:董 啸
第一卷(共60分)
可能用到的相对原子质量:H-1 C-12 Na-23 O-16 N-14 Si-28 S-32
Al-27 Li-6.9 K-39 Mg-24 Cl-37.5 Rb-85 Cs-133
一、选择题(每小题2分,共60分。每小题只有一个选项符合题意)
1.1992年,我国取得重大科技成果之一就是发现了三种元素新的同位素,其中一种是![]() ,它的中子数为( )
,它的中子数为( )
A、80 B、288 C、208 D、128
2.某元素X 的气态氢化物的化学式为XH3 ,则X 的最高价氧化物的水化物的化学式为( )
A、H2XO3 B、 HXO3 C、HXO4 D、H2XO4
3.已知反应 A + 3B ![]() 2C + D 在某段时间内以B的浓度变化表示的化学反应速率为4.5mol/(L.min),则此段时间内以C浓度变化表示的化学反应速率( )
2C + D 在某段时间内以B的浓度变化表示的化学反应速率为4.5mol/(L.min),则此段时间内以C浓度变化表示的化学反应速率( )
A、2 mol/(L.min) B、1 mol/(L.min)
C、6.75 mol/(L.min) D、3 mol/(L.min)
4. 美国“阿波罗号飞船”所用的氢氧燃料电池的电极应为:
负极:2H2+4OH--4e-=4H2O 正极 O2+2H2O+4e-=4OH-
该电池工作时,下列叙述正确的是( )

A.氢气发生还原反应 B.每转移4摩电子,电池内增加4摩水
C.负极附近溶液的PH值降低 D.正极附近H+浓度增大
5.在一定条件下,反应A2(g)+B2(g)![]() 2AB(g),达到反应限度的标志是( )
2AB(g),达到反应限度的标志是( )
A.容器内气体的总压强不随时间的变化而变化
B.单位时间内有nmolA2生成,同时就有nmolB2生成
C.单位时间内有nmolA2生成,同时就有2nmolAB生成
D.单位时间内有nmolB2生成,同时就有2nmolAB分解
6.下列四个数据都表示合成氨的反应速率,其中速率代表同一反应中的一组是( )
①V(N2)=0.3mol/L·min ②V(NH3)=0.9mol/L·min
③V(H2)=0.6mol/L·min ④V(H2)=0.0225mol/L·s
A.①② B.①③ C.③④ D.②④
7.物质发生化学反应时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是:
A、①②⑤ B、②③⑥ C、①②③ D、④⑤⑥
8.仿照电极方程式的书写,我们可以把一些氧化还原反应分成“氧化反应”和“还原反应”两个“半反应”,如Fe+2H+=Fe2++H2↑可分成氧化反应:Fe-2e-= Fe2+还原反应:2H++2e-= H2↑则下列正确的是
①Fe+2Fe3+=3Fe2+可分成
氧化反应:Fe-2e-= Fe2+ 还原反应:2 Fe3+ + 2e- =2 Fe2+
②MnO2+2Cl-+4H+=Mn2++Cl2↑+2H2O
氧化反应:2Cl--2e-=Cl2↑ 还原反应:MnO2+2e-+4H+=Mn2++2H2O
③Cl2+H2S=S↓+2H++2Cl-
氧化反应: Cl2↑+ 2e-= 2Cl- 还原反应:H2S- 2e-= S↓+ 2H+
A、③ B、②③ C、①② D、①②③
9.生活中常会碰到的某些化学问题,如:①“白雪牌”漂粉精可令所有有色物质黯然失“色”,没有最白,只有更白;②霸王洗发液不含任何化学物质;③人喝了啤酒会打嗝,是因为啤酒中的碳酸盐与胃酸反应生成了二氧化碳;④53度白酒是指该白酒的着火点是53℃;⑤太太口服液含丰富的氮、磷、锌等微量元素。则有关上述说法,你的看法是
A.全部正确 B.只有①⑤正确
C.只有③⑤正确 D.以上说法都是错误的
10.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是

A.反应的化学方程式为:2 M![]() N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
11.食品保鲜的措施有:添加防腐剂、充填保护气体、放置干燥剂和脱氧保鲜剂等。一次,小明在食用盒装月饼时,撕开了用于保鲜的小纸袋,发现其中盛放着一种灰黑色的粉末,几天后,看到灰黑色粉末变得有些发红。原保鲜剂粉末可能是
A.木炭粉 B.铝粉 C.还原性铁粉 D.氧化铜粉末
12.下列反应中,属于取代反应的是
①CH3CH=CH2+Br2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH ![]() CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O
A. ①② B.③④ C.①③ D.②④
13.用NA表示阿伏加德罗常数,下列说法正确的是( )
A.78g Na2O2与足量水反应中电子转移了2NA
B.只有在标准状况下NA个氧气分子的物质的量才是1mol
C.常温常压下,22.4L N2气体的分子数小于NA
D.20g D2O所含的中子数为9NA
14. 将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下。下列说法错误的是( )
|
物 质 |
a |
b |
c |
d |
|
反应前质量/g |
6.40 |
3.20 |
4.00 |
0.50 |
|
反应后质量/g |
待测 |
2.56 |
7.20 |
0.50 |
A、a和b是反应物,d可能是催化剂 B、反应后a物质的质量为4.64g
C、c物质中元素的种类,一定和a、b二种物质中元素的种类相同
D、若物质a与物质b的相对分子质量之比为2﹕1,则反应中a与b的化学计量数(系数)之比为2﹕l
15.据国外资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nd等的磷酸盐)中,查明有尚未命名的116、124、126号元素.判断其中116号应位于周期表中的 ( )
A.第六周期ⅣA族 B.第七周期ⅥA族
C.第七周期Ⅷ族 D.第八周期ⅥA族
16.下列反应的离子方程式正确的是( )
A.S02气体通入氯水中:SO2+2C1O-=2C1-+SO
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+ =3Fe3++4H2O
C.向NaA102溶液中通入少量CO2:
2A1O+CO2+3H2O= 2A1(OH)3 ↓+CO
D.澄清石灰水与过量苏打溶液混合:
Ca2++OH-+HCO CaCO3↓+H2O
17. 某种混合气体,可能含有N2、HCl、CO。把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量的Na2O2固体,气体体积减小;最后通过灼热的铜丝,经充分反应后气体体积又减小,但还有气体剩余。以下对混合气体组分的判断中,正确是
A.一定有N2、HCl,没有CO
B.一定有N2,CO和HCl中至少有一种
C.一定有N2、CO和HCl
D.一定没有N2,CO和HCl中至少有一种
18.已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是
|
选项 |
W |
|
|
A |
盐酸 |
Na2CO3溶液 |
|
B |
Cl2 |
Fe |
|
C |
CO2 |
Ca(OH)2溶液 |
|
D |
NaOH溶液 |
AlCl3溶液 |
19、下列叙述中错误的是
A.已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂得到11mole-
B.向NaClO溶液中通入少量SO2的离子方程式为:ClO-+SO2+H2O=Cl-+SO42-+2H+
C.已知反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,该反应中Cu2S既是氧化产物又是还原产物
D.某反应体系中的物质有:N2O、FeSO4、Fe2(SO4)3、HNO3、Fe(NO3)3、H2O,若H2O是生成物,则N2O是还原产物
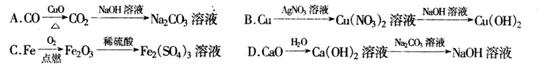
20. 下列制备物质的设计中,理论上正确、操作上可行、经济上合理的是( )
21. 已知A、B、C、D的原子序数都不超过18,它们的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-均具有相同的电子层结构,则下列叙述正确的是( )
A.原子序数:a>b>c>d B.离子半径:A(n+1)+>Bn+>C(n+1)->Dn-
C.离子还原性:A(n+1)+>Bn+,离子氧化性:C(n+1)->Dn-
D.单质还原性:B>A,单质氧化性:D>C
22.下列各组物质性质比较中,正确的是 ( )
A.氢化物沸点:HI>HBr>HCl>HF B.离子半径:K+>Cl->S2-
C.分子稳定性:HF>HCl>HBr>HI D.单质熔点:Li<Na<K<Rb
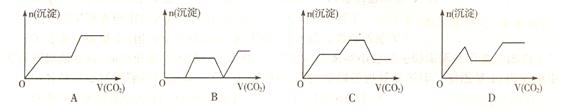
23. 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 ( )
24.右图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是
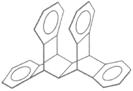 A.Janusene的分子式为C30H22
A.Janusene的分子式为C30H22
B.Janusene属于苯的同系物
C.Janusene苯环上的一氯代物有8种
D.Janusene可发生氧化反应,不能发生还原反应
25.阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为( )

下列说法正确的是( )
A.阿魏酸与香兰素可用酸性KMnO4溶液鉴别
B.香兰素、阿魏酸均可与NaHCO3、NaOH溶液反应
C.1mol香兰素最多可与5molH2发生加成反应
D.阿魏酸与溴水既能发生加成反应又能发生取代反应
26.已知反应:3BrF3+5H2O=Br2+HBrO3+9HF+O2,若生成标准状况下6.72L O2,则被H2O还原的BrF3的物质的量为( )
A.0.3mol B.0.4mol C.0.6mol D.0.9mol
27.美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
A.原子半径:Na>Al
B.铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出
D.m g不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越小
![]() 28、氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是 (1/2)H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
28、氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是 (1/2)H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池放电时,氢元素被还原
D.电池放电时,H2是负极
29.制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A. 烧杯中有铜无铁 B. 烧杯中有铁无铜
C. 烧杯中铁、铜都有 D.烧杯中铁、铜都无
30.一定条件下硝酸铵受热分解的未配平化学方程式为:NH4NO3—HNO3+N2+H2O,在反应中被氧化与被还原的氮原子数之比为( )
A.5:3 B.5:4 C.1:1 D.3:5
二、填空题(30分)
31.(8分)由以下一些微粒: 13 6C 、39 19K、40 20Ca 、12 6C 、14 7N 、40 18Ar
![]() 其中:(1)互为同位素的是________和________;
其中:(1)互为同位素的是________和________;
![]() (2)质量数相等,但不能互称同位素的是_________和__________;
(2)质量数相等,但不能互称同位素的是_________和__________;
![]() (3)中子数相等,但质子数不相等的是______和______、______和_______。
(3)中子数相等,但质子数不相等的是______和______、______和_______。
32.(8分)某种钮扣电池的电极材料为锌和氧化银,电解质溶液是氢氧化钾。总反应式为:Zn +Ag2O = ZnO +2Ag。电池的负极是(填材料名称) ,负极发生了(填“氧化”或“还原”) ![]() 反应,电极反应式是 。反应过程中溶液的pH (填增大、减小或不变)。
反应,电极反应式是 。反应过程中溶液的pH (填增大、减小或不变)。
33.(14分)A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为 。
(2)由A、B、W三种元素组成的18电子微粒的分子式为 。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式 。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和衡稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是 (标准状况下)。
(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,但有红褐色沉淀生成,则该反应的离子方程式为: 。
三、计算题(共10分)
34.在隔绝空气的条件下,某同学将一块被氧化钠覆盖的钠块用一张刺有小孔的纯净铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待反应完全后,在容器中收集到1.12 L H2(标准状况,忽略溶解的氢气的量),测得铝箔质量比反应前减少了0.27g,水槽和容器内溶液的总体积为2.0L,溶液中NaOH的浓度为0.050mol·L-1。 试通过计算确定该钠块中钠元素的质量分数(精确到0.1%)。
2011-2012学年度第二学期高一年级化学竞赛
答题卡
一、选择题
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
题号 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
二、填空题
31. (1) ;(2) ;(3) ; 。
32. ; ; ; 。
33.(1) ;(2) ;
(3) ; 。
(4) ;(5) ;
(6) 。
三、计算题
34.
高一化学竞赛参考答案及评分标准
一、选择题
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
答案 |
D |
B |
D |
C |
C |
D |
A |
C |
D |
D |
C |
B |
C |
B |
B |
|
题号 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
答案 |
C |
B |
B |
C |
D |
D |
C |
C |
A |
D |
B |
D |
D |
B |
A |
二、填空题(30分)
31.(1)13 6C 和12 6C(2)40 20Ca和40 18Ar (3)14 7N和 13 6C ;39 19K和 40 20Ca
32、锌;氧化反应;Zn + 2OH――2e-=ZnO + H2O ;不变。
33、(1)第三周期,IIIA族; (2)CH4O
![]() (3)H2O2 H++HO
(3)H2O2 H++HO![]() ;BaO2+H2SO4=BaSO4↓+H2O2;
;BaO2+H2SO4=BaSO4↓+H2O2;
(4)Cu+ H++H2O2=Cu2++2H2O
(5)56L ;(6)3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+
三、计算题(10分)
34. 88.8%.
由反应:Na2O+H2O = 2NaOH, 2Na+2H2O = 2NaOH+H2↑,
2Al+2NaOH+2H2O = 2NaAlO2+3H2↑…………………….. (1分)
则:n(余NaOH) = 2.0 L×0.05 mol·L-1 = 0.1 mol.............................(1分)
n(H2) =![]() =0.05 mol................................................................(1分)
=0.05 mol................................................................(1分)
n(Al) = n(NaAlO2)=![]() = 0.01 mol.......................................(1分)
= 0.01 mol.......................................(1分)
由电子守恒知:n(Na)+3n(Al) = 2n(H2)
即:n(Na)+3×0.01 mol = 2×0.05 mol,得:n(Na) = 0.07 mol …(1分)
由钠守恒知:n(NaAlO2)+n(NaOH) = n(Na)+2n(Na2O)
即:0.01 mol+0.1 mol = 0.07 mol+2n(Na2O).............................….…(1分)
得:n(Na2O) = 0.02 mol…………………………………..……… ….(1分)
w (Na) =![]() ×100%≈88.8%................... (2分)
×100%≈88.8%................... (2分)
(注:三个方程式得1分;若未写方程式,写出正确关系式也给1分。其它合理计算也参照给分)
上一篇:第二课时 乙酸
下一篇:第一节 开发利用金属矿物质和海水资源(1)

