高一化学试题
2015-10-16 10:01:43 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
2009-2010学年度十二月份月考
![]() 高一化学试题
高一化学试题
(考试时间100分钟,满分100分)
可能用到的相对原子质量:
H—1 O—16 N—14 C—12 C1—35.5 Mg—24 Ag—108 Al—27 Na—23 Fe—56 Ba—137 Cu—64 Zn—65
第Ⅰ卷 (选择题共46分)
注意:请将答案填写在答题纸上,否则不得分。
一、选择题(只有1个选项符合要求,共23题,每题2分,共46分)
1、在实验室中,对下列事故或药品的处理正确的是( )
A、金属钠失火时立即用水灭火
B、少量的金属钠应保存在煤油中
C、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D、用托盘天平称量药品时,将药品置于天平右盘
2、下列说法中正确的是( )
A、摩尔是七个基本物理量之一 B、阿伏加德罗常数是没有单位的
C、氧气的摩尔质量是32 g D、1mol H2O中含有6.02×1023个水分子
3、用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A、32g氧气所含原子数目为2NA
B、在标准状况下,22.4L水的物质的量是1mol
C、36.5g氯化氢的体积为22.4L
D、在常温常压下,11.2L氯气含有的分子数为0.5NA
4、下列反应中,因为反应条件改变,反应产物不同的是( )
A、钠与氧气反应 B、稀盐酸和硝酸银溶液
C、铁与稀硫酸反应 D、一氧化碳在氧气中燃烧
5、已知:3Cu+8HNO3=3Cu(NO3)2+2NO ↑+4H2O ,其中氧化剂与还原剂物质的量之比为( )
A、3∶8 B、2∶3 C、3∶2 D、8∶3
6、按分散质微粒直径大小不同可将分散系分为胶体、溶液和浊液,胶体微粒直径大小为( )
A、0.01nm~1nm B、0.1nm~10nm
C、1nm~100nm D、10nm~1000nm
7、某500mL溶液中含0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol 铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)( )
A、0.4 mol·L-1 B、0.6 mol·L-1 C、0.8 mol·L-1 D、1.0 mol·L-1
8、某无色透明溶液能与铝作用放出氢气, 此溶液中一定能大量共存的离子组是( )
A、Al3+、Ba2+、Cl-、NO3- B、K+、Na+、CO32-、NO3-
C、K+、Na+、NO3-、HCO3- D、Na+、K+、Cl-、SO42-
9、只用一种试剂可区别NH4Cl、MgCl2、FeCl2、FeCl3、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
A.Ba(OH)2 B.H2SO4 C.NaOH D.AgNO3
10、下列溶液中Cl-物质的量浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-物质的量浓度相等的是( )
A、150 mL 1 mol·L-1的NaCl溶液 B、75 mL 2 mol·L-1 NH4Cl溶液
C、150 mL 2 mol·L-1的KCl溶液 D、75 mL 1 mol·L-1的FeCl3溶液
11、下列离子方程式书写正确的是( )
A、铝粉投入到NaOH溶液中:2Al + 2OH- ══ 2AlO2- + H2↑
B、金属钠投入水中:Na + 2H2O ══ Na+ + 2OH- + H2↑
C、三氯化铁溶液中加入铁粉:Fe3+ + Fe = 2Fe2+
D、FeCl2溶液跟Cl2反应:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
12、日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
A、铜铸塑像上出现铜绿[Cu2(OH)2CO3] B、铁制菜刀生锈
C、大理石雕像被酸腐蚀毁坏 D、铝锅表面生成致密的氧化膜
13、取一小粒金属钠放在燃烧匙里加热,实验现象有下列叙述:
①金属钠先熔化 ②在空气中燃烧,产生紫色火焰 ③燃烧后生成白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体。其中描述正确的是( )
A、①② B、①②③ C、①④⑤ D、④⑤
14、用右图表示的一些物质或概念间的从属关系中不正确的是( )
|
|
X |
Y |
Z |
|
A |
氧化物 |
化合物 |
纯净物 |
|
B |
电解质 |
盐 |
化合物 |
|
C |
胶体 |
分散系 |
混合物 |
|
D |
碱性氧化物 |
金属氧化物 |
氧化物 |
15、除去下列物质中的杂质(括号内为杂质),选择试剂不正确的是( )
A、CO2(HCl)―饱和NaHCO3溶液 B、KCl(CaCO3)―HCl
C、NaCl(Na2SO4)―Ba(NO3)2溶液 D、Mg(Al)―NaOH溶液
16、随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品氧化变质,在包装中可以放入的化学物质是( )
A、硫酸亚铁 B、无水硫酸铜 C、食盐 D、生石灰
17、下列图示的四种实验操作名称从左到右依次是( )


A、过滤、蒸发、蒸馏、萃取 B、过滤、蒸馏、蒸发、萃取
C、蒸发、蒸馏、过滤、萃取 D、萃取、蒸馏、蒸发、过滤
18、在溶液中,Fe3+能把金属Cu氧化。若在FeCl3溶液中加入过量的铜粉,充分反应后,则溶液中存在的金属离子是( )
A、Fe2+ 和Cu2+ B、Fe3+ C、Cu2+ D、Fe2+
19、将5 mol·L-1的Mg(NO3)2溶液a ml稀释至b ml,稀释后溶液中NO3-的物质的量浓度为( )
A、![]() mol·L-1 B、
mol·L-1 B、![]() mol·L-1 C、
mol·L-1 C、![]() mol·L-1 D、
mol·L-1 D、![]() mol·L-1
mol·L-1
20、50mL的BaCl2溶液中所含有的Cl-可以被20mL0.5 mol·L-1的AgNO3溶液全部沉淀,则BaCl2溶液中Ba2+的物质的量浓度为( )
A.1 mol·L-1 B.0.8 mol·L-1 C.0.2 mol·L-1 D.0.1 mol·L-1
21、配制250mL 1 mol·L-1NaOH溶液,需进行下列操作:①在干燥洁净的滤纸上准确称量10.0g固体氢氧化钠,并转入洗净的烧杯中;②往烧杯中加入约80mL蒸馏水,用玻璃棒搅拌使之完全溶解;③立即将烧杯中的溶液沿玻璃棒注入250mL容量瓶中;④倒完烧杯中的溶液后,再小心加蒸馏水至液面接近刻度线1~2cm处;⑤改用胶头滴管滴加蒸馏水,使溶液凹液面最低处恰好与刻度线相切;⑥塞紧瓶塞,振荡均匀,静置,此时凹液面低于刻度线,再滴加蒸馏水至刻度线。其中操作正确的是( )
A、①②③⑤ B、②③④⑤ C、①②④⑤⑥ D、②⑤
22、在H2SO4酸化过的Al2(SO4)3溶液中滴加NaOH溶液,生成沉淀W(g)与所加NaOH溶液体积V的关系如图,其中正确的是( )
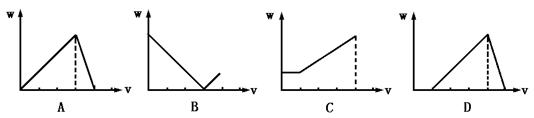
23、一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6L的气体,则该合金中铝、铁的物质的量之比为( )
A、1∶1 B、2∶5 C、3∶2 D、3∶5
第Ⅱ卷 (选择题共54分)
二、填空题(共26分)
24、(9分)下列物质中:⑴MgCl2 ⑵熔融的KNO3 ⑶盐酸 ⑷Ca(OH)2 ⑸酒精 ⑹Cu ⑺NaOH溶液 ⑻蔗糖 ⑼CaCO3 ⑽Na2O ⑾NaCl溶液 ⑿SO2 ⒀石墨 ⒁HCl气体
其中能导电的是 (用序号填空,下同);属于电解质的是 ;属于非电解质的是 。
25、(6分)相同质量的氢气、氧气、二氧化碳、甲烷、氮气,其中含分子数最多的是 ;含原子数最多的是 ;相同条件下,体积最小的是 。
26、(8分)现用Na2CO3固体配制500mL 0.200 mol·L-1的Na2CO3溶液。可供选择的仪器有:①玻璃棒;②烧瓶;③烧杯;④胶头滴管;⑤漏斗;⑥天平;⑦药匙
请回答下列问题:
(1)上述仪器中,在配制Na2CO3溶液时不需要使用的有 (填序号),还缺少的仪器是 (填仪器名称)。
(2)经计算,需Na2CO3固体质量为 。
(3)将所配制的Na2CO3溶液进行测定,发现浓度小于0.200 mol·L-1。请你选择配制过程中可能引起误差偏小的原因 。
A.定容时俯视液面 B.转移时没有洗涤烧杯和玻璃棒 C.配制时容量瓶没有干燥
27、(3分)下列操作能达到实验目的的是 (填写序号)。
①除去铝粉中混有的少量铁粉,可加入过量的氢氧化钠溶液,完全反应后过滤
②将饱和碘水中的碘提取出来,可用四氯化碳进行萃取
③制备Fe(OH)3胶体,通常是将FeCl3溶液注入热水中,并搅拌均匀
④除去Na2CO3固体中少量的NaHCO3,可用加热的方法
三、实验探究(共16分)
28、(10分)已知有以下物质之间的相互转化:

试回答:
(1)写出B的化学式 ,D的化学式 。
写出B溶液与C溶液反应的离子方程式 ;写出由D转变成H的化学方程式 。
(2)写出由E转变成F的化学方程式 。
(3)向G溶液中加入KSCN溶液的现象: ;
写出G溶液加入A的实验现象 。
29、(6分)甲、乙、丙三种物质之间有如下转化关系:甲![]() 乙
乙![]() 丙
丙![]() 甲。若甲和丙都是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液。则甲是 ,丙是 (填化学式)。写出“乙
甲。若甲和丙都是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液。则甲是 ,丙是 (填化学式)。写出“乙![]() 丙”转化的离子方程式: 。甲与氢氧化钠溶液反应的离子方程式: 。
丙”转化的离子方程式: 。甲与氢氧化钠溶液反应的离子方程式: 。
四、计算题(共12分)
30、(6分)铁粉和氧化亚铁(FeO)粉末的混合物共9.2克,加入到150mL的稀硫酸中,恰好完全反应,得到氢气2.24L(标准状况)。
求:(1)混合物中铁的质量。
(2)所用稀硫酸物质的量浓度。
31、(6分)实验室常用的浓盐酸密度为1.17g·mL-1、质量分数为36.5%。
(1)取此浓盐酸50mL,用蒸馏水稀释至200mL,试计算稀释后盐酸的物质的量浓度。
(2)将13g锌投入足量稀释后的稀盐酸中,放出H2在标准状况下的体积为多少?
附加题:(4分)将4.6g钠投入95.4g水中,6.2g氧化钠投入93.8g水中,7.8g过氧化钠投入92.2g水中,8.0g氢氧化钠投入92g水中,则所得溶液的溶质质量分数分别为a、b、c、d的大小关系是 。
 2009-2010学年度十二月份月考
2009-2010学年度十二月份月考
![]() 高一化学答题卡
高一化学答题卡
一、选择题(共46分)
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
题号 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
|
|
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
二、填空题(共26分)
24、(9分) ; ; 。
25、(6分) 、 、 。
26、(8分)(1) 、 (2) (3)
27、(3分)
三、实验探究(共16分)
28、(10分)(1) 、
B与C反应:
D转变成H:
(2)
(3) ; 。
29、(6分)(1)甲 、丙 。
四、计算题(共12分)
30、解:(1)
(2)
31、解:(1)
(2)
附加题:
上一篇:第三节 氧化还原反应
下一篇:第一节 无机非金属材料的主角—硅

