第五单元 金属及其化合物(3)
2015-11-09 11:17:01 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第五单元 金属及其化合物(3)
|
|
|
授课人:董 啸 |
|
|
①使学生对金属的性质有一个全面的了解。 |
|
|
教学目标: |
②使学生掌握镁、铝、铁的单质及化合物的性质。 |
|
|
|
③使学生将元素化合物知识形成网络。
|
|
|
教学重点: |
铝及其化合物的两性、铁的变价及有关化学反应 |
|
|
教学难点: |
镁、铝、铁及有关化合物性质及其离子的检验 |
|
|
教学方法: |
分析比较法 |
|
|
教学过程: |
第三课时 |
|
高考考点透析
一、考纲要求
(1)了解金属钠的物理性质,掌握钠和镁化学性质。
(2)从原子的核外电子排布,理解IA、ⅡA族元素(单质、化合物)的相似性和递变性。
(3)以氢氧化钠为例,了解重要的碱的性质和用途。了解钠的重要化合物。
(4)掌握Fe和Al的化学性质。
(5)了解常见金属的活动顺序。
(6)以Fe(Ⅱ)、Fe(Ⅲ)的相互转化为例,理解变价金属元素的氧化还原性。
(7)了解铝的重要化合物。
(8)初步了解合金的概念。了解金属的通性及金属冶炼的一般原理。初步了解金属的回收和资源保护。
(9)了解在生活和生产中常见的无机化合物的性质和用途。
(10)以上各部分知识的综合应用。
二、考点透析
钠及其化合物(Na2O、Na2O2、NaOH、Na2CO3、NaHCO3)的性质是高考考查的核心内容。其重点是:
①钠与水(盐溶液)反应的原理和现象。
②Na2O2与H2O、CO2反应的原理,会从电子转移角度来解释,注意反应前后的气体体积差和固体质量差在计算中的应用。
③NaOH为中学阶段最常用的碱性试剂,常跟酸、酸性氧化物、酸式盐反应,跟两性单质、两性氧化物、两性氢氧化物的反应,跟盐的反应和在有机反应(卤代烃、酯类水解)中的应用。
④Na2CO3和NaHCO3在与酸反应时的原理、快慢及消耗酸的量(或生成CO2的量)的大小比较。特别是Na2CO3溶液与盐酸反应时,混合顺序不同,反应原理也不同。高考题除在选择题中对这些知识直接考查外,还利用这些知识结合其他元素及化合物知识为载体,编制推断题、简答题和计算题。以Na2O2与H2O(或CO2)反应,产生氧气设计综合实验,也是高考的热点。
碱金属是典型的活泼金属,其化合物一般为离子化合物,既要注意碱金属元素与卤素化合的典型性,与氧族元素化合的复杂性(能形成过氧化物、超氧化物、多硫化物等),又要注意还能与氢、氮等元素形成离子化合物,并且注意这些化合物的性质(如易水解)。这也是无机信息题的一个很好的出题知识点,也是今后的一个命题方向。
典型试题剖析
一、高考新题赏析
1、(2012江苏高考)5. 下列有关物质的性质与应用不相对应的是
A. 明矾能水解生成Al(OH)3 胶体,可用作净水剂
B. FeCl3 溶液能与Cu 反应,可用于蚀刻印刷电路
C. SO2 具有氧化性,可用于漂白纸浆
D. Zn 具有还原性和导电性,可用作锌锰干电池的负极材料
2、(2012江苏高考)7. 下列物质的转化在给定条件下能实现的是

A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
3、(2012年安徽高考)13.已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1mol·L-1 的Fe(NO3)3 和Al(NO3)3混合液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是


4、(2012年北京高考)7.下列结实实验现象的反应方程式正确的是
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2
B.向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgC1+S2-=Ag2S↓+2C1-
C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2=2Na2CO3+O2
D.向Na HCO3溶液中加入过量的澄清石灰水,出现白色沉淀:
2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
9、(2012天津卷) 信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
⑴ 第①步Cu与酸反应的离子方程式为_____________________;
得到滤渣1的主要成分为___________________。
⑵ 第②步加H2O2的作用是_________________,使用H2O2的优点是___________;调溶液pH的目的是使____________________生成沉淀。
⑶ 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是____________。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
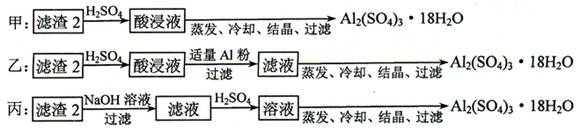
上述三种方案中,_________方案不可行,原因是_______________:
从原子利用率角度考虑,___________方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol LL-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2+ + H2Y2-= CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= ____________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡 c.未除净可与EDTA反应的干扰离子
答案:⑴ Cu + 4H+ + 2NO![]()
![]() Cu2+ + 2NO2↑+ 2H2O 或3Cu + 8H+ + 2NO
Cu2+ + 2NO2↑+ 2H2O 或3Cu + 8H+ + 2NO![]()
![]() 3Cu2+ + 2NO↑+ 4H2O Au、Pt
3Cu2+ + 2NO↑+ 4H2O Au、Pt
⑵ 将Fe2+氧化为Fe3+ 不引入杂质,对环境无污染 Fe3+、Al3+
⑶ 加热脱水
⑷ 甲 所得产品中含有较多Fe2(SO4)3杂质 乙
⑸ × 100% c
二、经典试题回顾
1.46g金属钠在空气中充分燃烧得到淡黄色粉末,该粉末与足量的水反应放出气体的体积是(标准状况下) ( )
A.44.8L B.11.2L C.22.4L D.5.6L
2.氢化钠(NaH)是一种白色的离子晶体,其中钠是+1价。NaH与水作用放出氢气,下列叙述中正确的是 ( )
A.NaH在水中显酸性
B.NaH中氢离子的电子层排布与氦原子相同
C.NaH中氢离子半径比锂离子半径大
D.NaH中氢离子可被还原成氢气
3.将一小块金属钾投入下列物质的溶液中,既能放出气体,又有沉淀析出的是 ( )
A.MgCl2 B.BaCl2 C.CuCl2 D.NaHCO3
4.下列关于碱金属的叙述中,正确的是( )
A.碱金属都可以保存在煤油中
B.碱金属与水反应均漂浮在水面上
C.碱金属在空气中加热均可生成多种氧化物
D.碱金属的硬度小、密度小、熔点低
5.相同质量的Na、Mg、Al分别与过量的盐酸反应,在相同条件下置换出H2的体积比是 ( )
A.36∶69∶92 B.23∶12∶9 C.1∶2∶:3 D.9∶12∶23
6.有无色溶液,加入Na2O2时有无色无味气体放出,并有白色沉淀生成,加入Na2O2的量与生成白色沉淀的量如图3-18所示。该无色溶液中含有的物质是( )

A.CaCl2和MgCl2 B.Al2(SO4)3
C.Al2(SO4)3和MgSO4 D.Na2SO4和MgSO4
7.两种固体物质混合后加热分解,残留固体的质量是原混合物质量的一半,这组混合物可能是下列的 ( )
A.Na2CO3和NaHCO3 B.MgCO3和Mg(OH)2
C.Fe(OH)3和Cu(OH)2 D.Cu(NO3)2和CaCO3
8.将4.34g Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672mL混合气体。该混合气体通过电火花引燃,恰好完全反应,则混合物中Na、Na2O和Na2O2的物质的量之比为 ( )
A.1∶1∶1 B.1∶1∶2 C.1∶2∶2 D.4∶3∶2
9.取镁铝合金粉末若干,用足量的盐酸溶解后,再向溶液中加入过量的NaOH溶液,将生成的沉淀过滤、洗涤、灼烧,得到的白色粉末与原合金粉末质量相等,则原合金中镁的质量分数是( D )
A.30% B.40% C.50% D.60%
14.有一硫化钠、亚硫酸钠和硫酸钠的混合物,经测定含硫25.6%,则混合物中含氧量为________________。
15.A、B、C是三种溶于水的白色固体,它们的水溶液都呈碱性,焰色反应都显紫色(透过蓝色的钻玻璃观察)。①A和B的水溶液反应时生成C。②固态B受热时产物之一为D。③C的水溶液和D反应生成B。④A的水溶液和D反应时,如果条件不同,可分别生成B或C。由此可推断出A、B、C的化学式依次是A______、B______、C______。
【教后记】
上一篇:第五单元 金属及其化合物(2.3)
下一篇:金属化学反应总结
