第二节 几种重要的金属化合物(2)
2015-10-20 09:08:12 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第二节 几种重要的金属化合物(2)
|
三维目标: |
|
授课人:董 啸 |
|
知识与技能: |
①掌握几种重要氢氧化物的性质。 |
|
|
|
②掌握Fe(OH)2氧化成Fe(OH)3的过程。 |
|
|
|
③通过实验和探究,让学生对探究的方法有一些了解。 |
|
|
过程与方法: |
①利用列表比较的方法培养学生的观察能力及综合分析能力。 |
|
|
|
②通过实物展示,启发诱导学生突破难点、巩固重点。 |
|
|
情感、态度 |
①结合铁的化合物的性质的教学,对学生进行辩证唯物主义教育。 |
|
|
与价值观 |
②通过学习物质的性质,培养学生学以致用。 |
|
|
教学重点: |
铝的氧化物和氢氧化物性质,铁离子的检验 |
|
|
教学难点: |
氢氧化铝的两性 |
|
|
教学方法: |
实验分析法 |
|
|
教学准备: |
多媒体课件,实验用品 |
|
|
教学过程: |
第2课时 |
|
[复习]钠的化合物写出重要的化学反应。
【过渡】上节课我们学习了钠的重要化合物,本节课我们继续探讨铝的重要化合物。铝是自然界含量最多的元素,但是由于性质活泼,在自然界以化合态存在,冶炼非常困难,铝的化合物有重要作用。
轶闻趣谈:法国皇帝拿破仑三世是一个喜欢炫耀自己的人。他常常大摆宴席,宴请天下宾客。每次宴会,餐桌上的用具几乎全是用银制成的,唯有他自己用的那一个碗是铝制品。这事要拿到现在,一定十分可笑,因为在今天,铝不仅比银便宜得多,而且光泽和性能都远远比不上银。为什么贵为法国皇帝,却不用高贵而亮丽的银碗,而用色泽要暗得多的铝碗呢?原来,在差不多200年前的拿破仑时代,冶炼和使用金银已经有很长的历史,宫廷中的银器比比皆是。可是,在那个时候,人们才刚刚懂得可以从铝矾土中炼出铝来,冶炼铝的技术还非常落后,炼铝十分困难。所以,当时铝是非常稀罕的东西,不要说平民百姓用不起,就是大臣贵族也用不上。拿破仑让客人们用银餐具,偏偏自己用铝碗,就是为了显示自己的高贵和尊严。铝之所以变得便宜,是因为后来人们发明了电解铝的技术,可以大量生产铝。铝已经非常普遍,谁还会像当年的拿破仑那样拿它来炫耀呢?
二、铝的重要化合物
〖引入〗氧化铝是冶炼铝的原料,也是重要的铝的化合物,所以我们首先来认识氧化铝。
1、氧化铝
[思考与交流]在学习金属的化学性质时我们曾经做过一个铝片在酒精灯上加热的实验,我们知道铝片加热后,并没有像镁带一样燃烧,你知道是为什么吗?
【学生活动】请同学们结合课本58页第一自然段,归纳氧化铝的物理性质。
(1)物理性质:难溶与水,熔点很高难熔。
(2)化学性质:
[科学探究]我们知道,氧化物按照组成元素可以分为金属氧化物和非金属氧化物两种,如果按照与酸和碱的反应情况又可以分为酸性氧化物和碱性氧化物。氢氧化铝属于什么氧化物呢?
[学生活动]1、按照组成元素分析,氧化铝属于什么氧化物?
【结论】按照组成元素分析,氧化铝属于金属氧化物。
【学生活动】2、利用氧化铝分别与酸和碱的反应分析,氧化铝属于什么氧化物?
Al2O3+6HCl==2AlCl3+3H2O Al2O3+2NaOH==2NaAlO2+H2O
离子方程式:Al2O3+2OH-=2AlO2-+H2O Al2O3+6H+=Al3++3H2O
【结论】既能跟酸反应,又能跟碱反应,生成盐和水的氧化物叫两性氧化物。
Al2O3属于两性氧化物。
(3)用途:
[ 分析]我们知道性质决定用途,请同学们根据氢氧化铝的性质推测氧化铝的用途。
【结论】氧化铝可以用做冶炼铝的原料和耐火材料。
【过渡】在了解了氧化铝之后,我们再来认识另一种铝的重要的化合物氢氧化铝。
2、氢氧化铝——Al(OH)3
(1)Al(OH)3的制取
[演示实验]3-7 在两支试管中各取10ml0.5mol/L硫酸铝溶液,分别滴加5滴氨水,观察Al(OH)3的颜色、状态。
实验现象:白色胶状沉淀
化学方程式: Al2(SO4)3 + 6NH3.H2O= 2Al(OH)3↓+3(NH4)2SO4
(2)Al(OH)3的性质
[演示实验]3-8 再向上述两支试管分别继续滴加过量的盐酸、氨水和氢氧化钠溶液,观察现象。
实验现象:加盐酸和氢氧化钠白色沉淀溶解,加氨水白色沉淀不溶解。
化学方程式:
Al(OH)3 + 3HCl == AlCl3 + 3H2O ;Al(OH)3 +NaOH == NaAlO2 +2 H2O
离子方程式:
Al(OH)3 + OH- == AlO2- +2 H2O ; Al(OH)3 +3 H+ == Al3+ + 3H2O
既能跟酸反应生成盐和水,又能跟碱反应生成盐和水的氢氧化物叫两性氢氧化物。如两性氢氧化物Al(OH)3。
【学与问】用可溶性盐和碱反应制取氢氧化铝时,为什么使用氨水而不使用氢氧化钠?
(3)Al(OH)3的热稳定性
2Al(OH)3加热Al2O3+3H2O
(4)Al(OH)3的用途:
氢氧化铝可以用于净化水,也可以做治疗胃酸过多的药物。
〖资料卡片〗学生自学了解明矾的组成和性质。
(5)Al3+检验
请同学们思考如何检验Al3+ ?
Al3+检验方法:取少量样品,逐滴加入氢氧化钠溶液,观察现象。若产生白色沉淀,继续加氢氧化钠溶液,白色沉淀消失,说明存在Al3+。
【知识拓展】
①盐酸和偏铝酸钠反应的方程式:
NaAlO2 + H2O +2HCl == NaCl+Al(OH)3↓
②二氧化碳与偏铝酸钠反应的方程式:
CO2 +NaAlO2 +2 H2O= Al(OH)3↓+NaHCO3
③三氯化铝和偏铝酸钠反应的方程式:
AlCl3 + 3NaAlO2 +6 H2O= 4Al(OH)3↓+3 NaCl
【思考与交流】
1、将氢氧化钠溶液逐滴加入氯化铝溶液中,实验现象是什么?若加液顺序不同现象有何区别?请用加入液体的体积与沉淀的量的关系图来说明。
2、将盐酸溶液逐滴加入偏铝酸钠溶液中,实验现象是什么?若加液顺序不同现象有何区别?请用加入液体的体积与沉淀的量的关系图来说明。
【过渡】铁是使用最为广泛的金属元素,下面我们来探究铁的重要化合物。
三、铁的重要化合物
〖概况〗铁在地壳中的含量为氧、硅和铝后的第四位,主要化合价为+2和+3。铁是最常见的变价金属,在实际中应用较广。
1、铁的氧化物
|
化学式 |
FeO |
Fe2O3 |
Fe3O4 |
|
名称 |
氧化亚铁 |
三氧化二铁 |
四氧化三铁 |
|
俗名 |
—— |
铁红 |
磁性氧化铁 |
|
价态 (稳定性) |
+2 (不稳定) |
+3 (稳定) |
+2、+3 (稳定) |
|
颜色、状态 |
黑色粉末 |
红棕色粉末 |
黑色晶体 |
|
溶解性 |
不溶于水 |
不溶于水 |
不溶于水 |
(1)制取反应:
3Fe + 2O2 ══ Fe3O4 3Fe + 4H2O(气)高温 Fe3O4 + 4H2
(2)氧化亚铁的性质:
6FeO + O2△ 2Fe3O4 FeO + 2H+ ═ Fe2+ +H2O
(3)氧化铁的性质:
Fe2O3 + 6H+ ═ Fe3+ + 3H2O
【说明】FeO和Fe2O3属于碱性氧化物,都能与酸反应,生成相应的盐和水,Fe3O4也能与酸反应,但不属于碱性氧化物。
2、铁的氢氧化物——Fe(OH)2、Fe(OH)3
FeO和Fe2O3对应的碱分别为Fe(OH)2和Fe(OH)3
⑴制备:
【演示实验】3-9在两支试管里分别加入少量FeCl3和FeSO4溶液,然后滴入NaOH溶液。观察并描述发生的现象。
Fe3+ + 3OH—= Fe(OH)3↓(红褐色) Fe2+ + 2OH— = Fe(OH)2↓(白色)
现象:白色沉淀,迅速变成灰绿色,最后变成红褐色。
思考题:
1、在制取Fe(OH)2时,为什么很快会颜色的变化?
原因:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
2、为了观察Fe(OH)2,你认为可以采取哪些措施减慢Fe(OH)2的氧化?(提示:O2存在溶液和空气中)
[结论]:①除去溶于NaOH溶液中的O2;②FeSO4易被空气中的氧气所氧化生成Fe2(SO4)3,防止空气中的O2进入反应液。
⑵性质:
Fe(OH)2 + 2H+ = Fe2++ 2H2O; Fe(OH)3 + 3H+ = Fe3+ + 3H2O
2Fe(OH)3 △ Fe2O3 + 3H2O
[思考与交流]制备Fe(OH)3和Fe(OH)2后的试管如何清洗?(用盐酸)
3、铁盐和亚铁盐
(1)Fe3+和 Fe2+的性质
①特殊颜色:与KSCN反应产生特殊颜色
【演示实验】3-10在一支试管里加入5 mL FeCl2溶液,滴入几滴KSCN溶液,观察颜色的变化。在一支试管里加入5 mL FeCl3溶液,滴入几滴KSCN溶液,观察颜色的变化。
|
项 目 |
滴入几滴KSCN溶液 |
|
FeCl2溶液 |
|
|
FeCl3溶液 |
|
【实验现象】FeCl2溶液滴入几滴KSCN溶液不变色,FeCl3溶液滴入几滴KSCN溶液变红色。Fe3++SCN-= [Fe(SCN)]2+(红色离子)。
②与NaOH溶液反应
Fe3+ + 3OH—= Fe(OH)3↓(红褐色) Fe2+ + 2OH— = Fe(OH)2↓(白色)
〖结论〗:利用Fe2+、Fe3+分别与KSCN溶液和NaOH溶液反应时现象的不同,可以检验Fe2+、Fe3+。
(2)Fe2+、Fe3+的转化
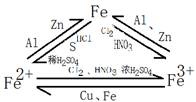
讨论:如何实现Fe2+、Fe3+的转化?在转化中表现了Fe2+、Fe3+的什么性质?
【科学探究】在一支试管里加入5 mL FeCl3溶液,加入几滴盐酸和适量铁粉,振荡试管。充分反应后,滴入几滴KSCN溶液,再加入几滴氯水。
|
项 目 |
实验现象 |
离子方程式 |
|
FeCl3溶液加入足量铁粉,滴入几滴KSCN溶液 |
|
|
|
上层清液加入几滴氯水,振荡 |
|
|
①Fe2+与氯水反应:2Fe2++Cl2=2 Fe3++2Cl—
②铁与Fe3+反应:Fe+2Fe3+=3 Fe2+
③Fe3+和铜反应:Cu+2Fe3+=2 Fe2+ +Cu2+
【结论】Fe2+在强氧化剂氧化后转化为Fe3+,Fe3+在强还原剂还原后转化为Fe2+。
铁的三角关系:
(3)Fe2+、Fe3+的检验
①Fe3+的检验方法:
※取少量样品,滴加几滴KSCN溶液,观察溶液颜色是否变红色,若变为红色,说明原溶液中含有Fe3+。
※取少量样品,滴加少量NaOH溶液,观察是否产生红褐色沉淀,若产生红褐色沉淀,说明原溶液中含有Fe3+。
②Fe2+的检验:
※取少量样品,滴加几滴KSCN溶液,观察溶液颜色是否变色,若不变色,加入少量氯水,观察观察溶液颜色是否变红色,若溶液颜色变红色,说明原溶液中含有Fe2+。
※取少量样品,滴加少量NaOH溶液,观察是否产生白色沉淀,若产生白色沉淀,迅速变为灰绿色,最终变为红褐色,说明原溶液中含有Fe2+。
实践活动:铝盐和铁盐的净水作用
课后思考题
1、下面有关碳酸钠与碳酸氢钠性质的描述,不正确的是( )
A 受热时碳酸钠比碳酸氢钠稳定。 B 在水中碳酸钠比碳酸氢钠溶解性大。
C 物质的量相等的碳酸氢钠和碳酸钠分别溶于水后,碳酸氢钠水溶液碱性较强。
D 相同质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,碳酸钠放出的二氧化碳比碳酸氢钠少。
2、有一瓶硫酸亚铁溶液,由于保管不当或时间过长,怀疑有可能变质是设计实验证明试样中的硫酸亚铁是部分被氧化,全部被氧化还是完全没被氧化。
3、在含有1molFeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤,然后在空气中灼烧沉淀得到的固体物质是( )
A、Fe B、FeO C、Fe(OH)3 D、Fe2O3
4、实验室中,要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜用的试剂是( )
A、NaOH溶液 B、Ba(OH)2溶液 C、盐酸 D、氨水
☆3、(2000年高考题)把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为( )
A.70% B.52.4% C.47.6% D.30%
〖板书设计〗 二、铝的重要化合物
1、氧化铝:(1)物理性质(2)化学性质:两性氧化物
2、氢氧化铝——Al(OH)3
(1)Al(OH)3的制取 (2)Al(OH)3的两性 (3)Al(OH)3的热稳定性
三、铁的重要化合物
1、铁的氧化物:(1)制取反应 (2)氧化亚铁的性质 (3)氧化铁的性质:
2、铁的氢氧化物:⑴制备 ⑵性质:
3、铁盐和亚铁盐:(1)Fe3+和 Fe2+的检验; (2)Fe2+、Fe3+的转化
〖教后记〗
上一篇:第二节 几种重要的金属化合物(1)
下一篇:第三节 用途广泛的金属材料
