第五单元 金属及其化合物(2.2)
2015-11-09 11:15:22 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第五单元 金属及其化合物(2.2)
|
|
|
授课人:董 啸 |
|
|
①使学生对金属的性质有一个全面的了解。 |
|
|
教学目标: |
②使学生掌握镁、铝、铁的单质及化合物的性质。 |
|
|
|
③使学生将元素化合物知识形成网络。
|
|
|
教学重点: |
铝及其化合物的两性、铁的变价及有关化学反应 |
|
|
教学难点: |
镁、铝、铁及有关化合物性质及其离子的检验 |
|
|
教学方法: |
分析比较法 |
|
|
教学过程: |
第二课时 |
|
基础知识精析
【专题探索】Al3+、Al(OH)3、AlO之间的转化关系
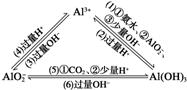
(1)①Al3++3NH3·H2O===Al(OH)3↓+3NH
②Al3++3AlO+6H2O===4Al(OH)3↓ ③Al3++3OH-===Al(OH)3↓
(2)Al(OH)3+3H+===Al3++3H2O
(3)Al3++4OH-===AlO+2H2O
(4)AlO+4H+===Al3++2H2O
(5)①AlO+CO2+2H2O===Al(OH)3↓+HCO
②AlO+H++H2O===Al(OH)3↓
(6)Al(OH)3+OH-===AlO+2H2O
Al(OH)3的两性:
Al2O3+6H+=2Al3++3H2O Al2O3+2OH-=2+H2O
Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=+2H2O
【思考题1】:为什么Al(OH)3既溶于酸又溶于碱?
两性氢氧化物,两种电离方式:

Al3+、Al(OH)3、的相互转化关系:
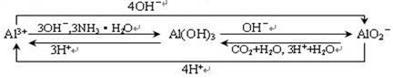
【说明】①实验室不宜用Al3+和强碱溶液、和强酸溶液反应来制备Al(OH)3,宜用Al3+和NH3•H2O或将CO2气体通入溶液中制备Al(OH)3。
②Al3+只存在于酸性溶液中,只存在于碱性溶液中,所以,Al3+和不能共存于同一溶液中。
③Al(OH)3只能溶于强酸或强碱溶液,不能溶于弱酸或弱碱溶液。
【思考题2】:为什么AlCl3溶液蒸发蒸干主要得Al2O3,Al2(SO4)3溶液蒸干主要得Al2(SO4)3?
答:尽管AlCl3、Al2(SO4)3溶液中都是Al3+水解,但在生成共同的水解产物Al(OH)3的同时,前者生成易挥发的HCl,后者则是生成难挥发的H2SO4。因此,在蒸发AlCl3溶液时由于HCl的挥发而促进AlCl3的水解,故主要得Al2O3 [Al(OH)3分解而成];而在蒸发Al2(SO4)3溶液时由于H2SO4难挥发导致H2SO4浓度增大,抑制Al3+的水解,故主要得Al2(SO4)3。
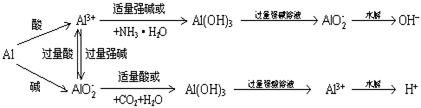
![]() 能与OH-共存,Al3+能与H+共存,但
能与OH-共存,Al3+能与H+共存,但![]() 与Al3+不能大量共存,Al3+与OH-、
与Al3+不能大量共存,Al3+与OH-、![]() 与H+不能大量共存。
与H+不能大量共存。
Al3++3H2O![]() Al(OH)3+3H+ +2H2O
Al(OH)3+3H+ +2H2O![]() Al(OH)3+OH-
Al(OH)3+OH-
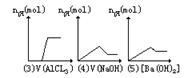
(1)有关实验及图像:
①将NaOH溶液逐滴加入AlCl3溶液中
②将HCl溶液逐滴加入NaAlO2溶液中
③将AlCl3溶液逐滴加入NaOH溶液中或将NaAlO2溶液滴加入HCl溶液中
④将NaOH溶液逐滴加入MgCl2和AlCl3混合溶液中
⑤将Ba(OH)2溶液逐滴加入明矾溶液中

(2)铝盐与强碱作用的计算题
Al3++3OH- = Al(OH)3↓ ;Al(OH)3+ OH-= ![]() +2H2O
+2H2O
总反应: Al3++4OH- = ![]() +2H2O
+2H2O
反应所得沉淀的量与加入碱的量的关系:
当 (OH-) =3n(Al3+)时, 铝盐与强碱恰好按Al3++3OH- = Al(OH)3↓反应, n(Al(OH)3)=1/3 n (OH-) = n (Al3+)
当n(OH-)<3n(Al3+)时,强碱不足量,铝盐有剩余。 n(Al(OH)3)=1/3 n(OH-)
当n(Al3+)< n(OH-)< 4n(Al3+),强碱过量,使Al(OH)3部分溶解,剩余Al(OH)3的物质的量:n[Al(OH)3]=n(Al3+)-[n(OH-)-3n(Al3+)]=4n(Al3+)-n(OH-)
当n(OH-)≥4n(Al3+),强碱大大过量,使Al(OH)3全部溶解,n[Al(OH)3]=0。
【探究高考】
1.判断正误,正确的划“√”,错误的划“×”
(1)Al箔插入稀HNO3中,无现象,说明Al箔表面被HNO3氧化,形成致密的氧化膜 (×) (2011·安徽理综,10C)
解析 铝在浓HNO3中钝化。
(2)加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO、NO (√) (2011·天津理综,5C)
(3) 如图所示,①AlCl3溶液、②浓氨水,①中有白色沉淀生成 (√)
如图所示,①AlCl3溶液、②浓氨水,①中有白色沉淀生成 (√)
(2012·北京理综,10C改编)
解析 浓氨水中挥发出NH3,NH3与AlCl3溶液反应生成Al(OH)3白色沉淀。
(4)新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-===2AlO+H2O (√)
(2012·海南,12D)
(5)Al2O3NaOH(aq)△NaAlO2(aq)Al(OH)3 (√) (2012·江苏,7①)
解析 反应原理为Al2O3+2OH-===2AlO+H2O,AlO+CO2+2H2O===Al(OH)3↓+HCO。
(6)AlCl3溶液中滴加NaOH后铝的存在形式:
 (√)(2008·江苏,13C)
(√)(2008·江苏,13C)
解析 根据Al3++3OH-===Al(OH)3↓、Al3++4OH-===AlO+2H2O。①<3时,铝的存在形式为Al(OH)3、Al3+;②3<<4时,铝的存在形式为Al(OH)3、AlO;③>4时,铝的存在形式为AlO。
2.(2008·四川延考,7)20 g由两种金属粉末组成的混合物,与足量的盐酸充分反应后得到11.2 L氢气(标准状况),这种金属混合物的组成可能是 ( )
A.Mg和Al B.Al和Fe C.Fe和Zn D.Zn和Cu
答案 B 解析 11.2 L氢气的物质的量为0.5 mol,假设均为+2价金属与盐酸反应生成,则+2价金属的总物质的量为0.5 mol,所以+2价金属的平均摩尔质量为=40 g·mol-1。因为为两种金属的混合物,则其摩尔质量应一个比40 g·mol-1大,一个比40 g·mol-1小;比较选项中各金属的相对原子质量可以得出答案为B(其中Al作为+2价时其摩尔质量为27×=18 g·mol-1;铜等不反应的金属的摩尔质量为无穷大)。
3.(2012·安徽理综,13)已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是 ( )
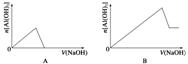

答案 C 解析 解答本题时应特别注意,难溶物的Ksp越大,在溶液中越难形成沉淀;Al(OH)3能溶于过量的NaOH溶液。由于Al(OH)3的Ksp比Fe(OH)3的Ksp大,故在混合液中加入NaOH溶液时,先生成Fe(OH)3沉淀,而不生成Al(OH)3沉淀,当Fe(NO3)3反应完全后再生成Al(OH)3沉淀,继续加入NaOH溶液,Al(OH)3沉淀又溶解,故只有C图像符合题意。
4.(2009·四川理综,11)向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol·L-1氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是 ( )
A.c= B.p=m+ C.n=m+17Vc D.m<p<m
答案 C
解析 向m g Mg、Al的混合物中加入适量的稀H2SO4,恰好完全反应,溶液中只有MgSO4、Al2(SO4)3两种物质,且Mg2+与Al3+的质量和为m g;向反应后的溶液中加入 c mol·L-1 KOH溶液V mL,使金属离子恰好完全沉淀,发生的反应是Mg2++2OH-===Mg(OH)2↓,Al3++3OH-===Al(OH)3↓,则得到沉淀的质量是Mg2+、Al3+的质量与KOH溶液中OH-质量的质量和,所以n=m+V×10-3×c×17=m+1.7×10-2 Vc,C项错误。
5.[2012·山东理综,30(1)(4)]实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
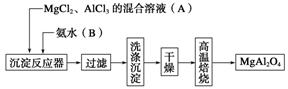
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(4)无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

装置B中盛放饱和NaCl溶液,该装置的主要作用是______________。F中试剂的作用是________________。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为__________。
答案 (1)B (4)除去HCl 吸收水蒸气 碱石灰(或NaOH与CaO混合物)
解析 (1)Mg(OH)2的溶解度小于Al(OH)3,向MgCl2、AlCl3溶液中加入氨水,Mg2+先产生沉淀,为使沉淀同时生成,应先向反应器中加入B。
(4)B中NaCl溶液的作用是除去Cl2中混有的HCl,F中试剂的作用是防止G中的水蒸气进入E中,使AlCl3遇H2O反应产生大量白雾;用一件仪器装填适当试剂可起到F和G的作用,所加试剂应既能防止水蒸气进入E又能吸收尾气Cl2,故可装填碱石灰。
〖教后记〗
上一篇:第五单元 金属及其化合物(2.1)
下一篇:第五单元 金属及其化合物(2.3)
