第五单元 金属及其化合物(1.2)
2015-11-09 11:11:28 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第五单元 金属及其化合物(1.2)
|
|
|
授课人:董 啸 |
|
|
①了解钠的原子结构,物理性质,保存方法。 |
|
|
教学目标: |
②掌握钠、氧化钠、过氧化钠的重要性质。 |
|
|
|
③掌握碳酸钠、碳酸氢钠的性质、转化和制法。
|
|
|
教学重点: |
碱金属的物理性质和化学性质、碱金属性质的差异及递变规律 |
|
|
教学难点: |
Na2O2,Na2CO3,NaHCO3的性质以推断题形式考查 |
|
|
教学方法: |
根据核外电子排布做好定位,推测化学性质,然后再去分析。 |
|
|
教学过程: |
第二课时 |
|
基础知识精析
3、氢氧化钠(NaOH)
(1)物理性质:NaOH的俗名为烧碱、火碱或苛性钠;它是一种白色固体,易溶于水并放出大量的热,有腐蚀性;易吸收空气中的水分。
(2)化学性质:具有碱的通性
①能使酸碱指示剂变色。
②与强酸反应的离子方程式为:H++OH-=H2O。
③与酸性氧化物、两性氧化物反应:
与CO2反应的离子方程式为:CO2+2OH-= CO32-+H2O
与Al2O3反应的离子方程式为:Al2O3+2OH-= 2AlO2-+ H2O。
④与盐反应:
与NH、Cu2+反应的离子方程式分别为:
NH+2OH-= NH3+ H2O Cu2++2OH-= Cu(OH)2
与HCO-反应的离子方程式为:HCO-+2OH-= CO32-+ H2O
⑤与某些单质反应:与Al、Si反应
2Al+2NaOH+2H2O=2Na AlO2+3H2↑
Si+2NaOH+H2O=Na2SiO3+2H2↑
(3)NaOH的制取
①土法制碱:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH;
②现代工业制碱:2NaCl+2H2O2NaOH+H2↑+Cl2↑。
(4)NaOH在有机反应中的应用
提供碱性环境,如:卤代烃的水解和消去反应,酯类的水解和油脂的皂化。
![]() 思考与交流
思考与交流![]()
①实验室称量NaOH固体时应注意什么问题?
②盛放NaOH溶液等碱性溶液的试剂瓶为什么不用磨口玻璃塞?
4.碳酸钠和碳酸氢钠:
(1)物理性质:①溶解性 ②颜色状态
(2)化学性质:
①稳定性:2NaHCO3![]() Na2CO3+CO2↑+H2O(注意:碳酸钠受热不分解。)
Na2CO3+CO2↑+H2O(注意:碳酸钠受热不分解。)
②与酸反应:
Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl=2NaCl+H2O+CO2↑
注意:反应速率不同,盐酸用量不同,逐滴加入及加液顺序改变时反应现象不同。
③与碱反应:
NaHCO3+NaOH=Na2CO3+H2O
2NaHCO3+Ba(OH)2=2H2O+BaCO3↓+Na2CO3
NaHCO3+Ba(OH)2=H2O+BaCO3↓+NaOH
Na2CO3+Ba(OH)2=BaCO3↓+2NaOH
说明:HCO3-不能与H+、OH- 共存。
练习:分别写出Na2CO3和NaHCO3分别与BaCl2和AlCl3反应的离子方程式。
④相互转化:
2NaHCO3=Na2CO3+CO2↑+H2O Na2CO3+CO2+H2O=2NaHCO3
⑤制法:
CO2+2NaOH=Na2CO3+H2O (CO2充足)
CO2+NaOH=NaHCO3 (CO2不足)
※ 候德榜制碱法:我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业作出了突出贡献。以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O===NH4HCO3 (注意:先通NH3,后通CO2) ;
NH4HCO3+NaCl===NaHCO3↓+NH4Cl;
2NaHCO3Na2CO3+CO2↑+H2O。
注意:有关过氧化钠、碳酸钠、碳酸氢钠的差量计算是本单元的重点和难点,应引起大家的高度重视。
【思考与交流】
1、向饱和Na2CO3溶液中通入过量的CO2,可观察到什么现象?为什么?
2、Na2CO3和NaHCO3如何鉴别?①加热法;②滴加盐酸;③BaCl2
3、CO32-和HCO3-鉴别: ①加入BaCl2溶液;②滴加盐酸。
4、标准状况下,将3.36 L CO2气体通入200 mL 1.00 mol·L-NaOH溶液中,充分反应后溶液中c(CO)与c(HCO)的比值为(不考虑CO、HCO的水解)( )
A.1∶1 B.1∶2 C.2∶1 D.1∶3
【专题探究】Na2CO3、NaHCO3与盐酸的反应
1.盐酸逐滴加入Na2CO3溶液
(1)现象:开始无明显现象,后有无色气体放出。
(2)反应:无明显现象时反应的离子方程式:CO+H+===HCO,无色气体放出时反应的离子方程式:HCO+H+===CO2↑+H2O。
2.Na2CO3溶液逐滴加入稀盐酸中
(1)现象:有无色气体放出。
(2)反应的离子方程式:CO+2H+===CO2↑+H2O。
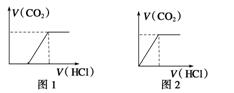
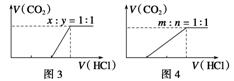
3.碳酸钠、碳酸氢钠与盐酸反应的基本图象的归纳总结
(1)向Na2CO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图1所示;
(2)向NaHCO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图2所示;
(3)向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图3所示(设NaOH、Na2CO3的物质的量之比x∶y=1∶1,其他比例时的图象略);
(4)向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图4所示(设Na2CO3、NaHCO3的物质的量之比m∶n=1∶1,其他比例时的图象略)。
例题、取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:

(1)原NaOH溶液的物质的量浓度为______________。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________,其物质的量之比为________________________________。
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为________mL。
![]() 深度思考
深度思考![]()
1.判断正误,正确的划“√”,错误的划“×”
(1)向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:
2HCO+Ca2++2OH-===CaCO3↓+CO+2H2O (×)
(2012·北京理综,7D)
(2)NaOH+NaHCO3===Na2CO3+H2O可用H++OH-===H2O表示 (×)
(2010·大纲全国卷Ⅱ,6C)
(3)向Na2CO3溶液中滴入酚酞试液,溶液变红CO+H2O=HCO+OH- (√)
(2010·北京理综,10D)
(4)小苏打与氢氧化钠溶液混合 HCO+OH-===CO2↑+H2O (×)
(2009·广东理基,32B)
(5)向Na2CO3溶液中加入过量CH3COOH溶液CO+2H+―→CO2↑+H2O
(×) (2008·上海,20C)
2.将CO2气体通入到饱和Na2CO3溶液中有何现象?原因是什么?
答案:开始无明显现象,后有沉淀析出。原因是NaHCO3的溶解度小于Na2CO3的溶解度,而且反应消耗溶剂水。
3.Na2CO3固体粉末中混有少量NaHCO3,用什么方法除杂?Na2CO3溶液中混有少量NaHCO3,用什么方法除杂?NaHCO3溶液中混有少量Na2CO3,用什么方法除杂?
答案 用加热法可以将Na2CO3固体粉末中混有的NaHCO3转化为Na2CO3;向混合液中滴加适量的NaOH溶液,可以将其中的NaHCO3转化为Na2CO3;向混合液中通入过量的CO2气体,可以将Na2CO3转化为NaHCO3。
【思维建模】
题组一 Na2CO3、NaHCO3的鉴别
1.下列几种试剂能把等物质的量浓度的Na2CO3、NaHCO3鉴别开的是___。
(1)CaCl2溶液 (2)澄清石灰水 (3)稀盐酸 (4)pH试纸
答案 (1)(3)(4)
2.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
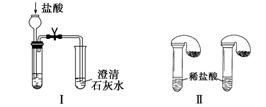
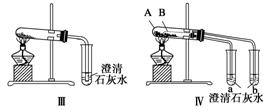
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是_______ (填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为________;
与实验Ⅲ相比,实验Ⅳ的优点是________(填选项序号)。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是______(填化学式)。
答案 (1)Ⅱ;(2)2NaHCO3Na2CO3+H2O+CO2↑,CO2+Ca(OH)2===CaCO3↓+H2O ,D ;(3)NaHCO3
解析 (1)图Ⅰ不能达到实验目的,因为无论碳酸钠还是碳酸氢钠均可以与盐酸反应产生二氧化碳,二氧化碳气体与澄清石灰水作用变浑浊,故不可以;图Ⅱ可以鉴别,因为等质量的碳酸钠和碳酸氢钠与足量的稀盐酸反应,生成的二氧化碳气体的量不同,可根据气球膨胀程度来判断。
(2)图Ⅲ、Ⅳ所涉及的化学方程式为2NaHCO3Na2CO3+H2O+CO2↑,实验Ⅳ的优点是可同时做对比实验。
(3)试管B装入碳酸氢钠,试管A装入碳酸钠,这样直接加热的碳酸钠,温度高,不分解,不能使澄清石灰水变浑浊,而间接加热的碳酸氢钠分解,使澄清石灰水变浑浊,表明了碳酸氢钠很不稳定。
题组二 有关Na2CO3、NaHCO3的定量计算
3.(1)①纯净的Na2CO3 a g ②Na2CO3与NaHCO3的混合物a g ③纯净的NaHCO3 a g,按要求回答下列问题:
A.分别与盐酸完全反应时,耗酸量从大到小的顺序为__________。
B.分别和盐酸完全反应时,放出CO2气体的量从大到小的顺序为_____。
C.分别溶于水,再加入足量的澄清石灰水,生成沉淀的质量从大到小的顺序为___________________。
D.分别配成等体积的溶液,c(Na+)的浓度从大到小的顺序为_________。
(2)将a g Na2CO3和NaHCO3的混合物充分加热,其质量变为b g,则Na2CO3的质量分数为__________。
(3)若将问题(1)中的等质量改为等物质的量,回答上述A、B、C、D四问。
答案 (1)A.①>②>③ B.③>②>① C.③>②>①
D.①>②>③
(2)×100%
(3)A.①>②>③ B.①=②=③ C.①=②=③
D.①>②>③
4.(2010·上海,11)将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是 ( )


答案 C
解析:滴加盐酸先发生反应OH-+H+―→H2O,再发生反应CO+H+―→HCO,最后发生反应:HCO+H+―→CO2↑+H2O;因n(OH-)=n(CO)=0.01 mol,故加入0.02 mol HCl后开始有气体生成,故C正确。
题组三 有关碳酸钠的制取及性质实验探究
5.Na2CO3的制取方法及综合实验探究
(1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下:

①往饱和食盐水中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是___________________________________。
②从生产流程图可知,可循环利用的物质是__________。
③写出沉淀池中、煅烧炉中反应的化学方程式______________。
(2)如何用CO2和50 mL 2 mol·L-1 NaOH溶液制取50 mL 1 mol·L-1 Na2CO3溶液?
①写出简要的实验步骤:__________________________________________。
②写出有关反应的化学方程式:_________________。
答案 (1)①由于CO2在NaCl溶液中的溶解度很小,先通入NH3使食盐水呈碱性,能够吸收大量CO2气体,产生较高浓度的HCO,才能析出NaHCO3晶体
②食盐水,CO2
③NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl、
2NaHCO3Na2CO3+CO2↑+H2O
(2)①将50 mL 2 mol·L-1 NaOH溶液等分成两份,在一份NaOH溶液中通入过量的CO2气体,再将两溶液混合,即得50 mL 1 mol·L-1 Na2CO3溶液
②NaOH+CO2===NaHCO3、NaHCO3+NaOH===Na2CO3+H2O
6.变量控制思想在实验探究中的应用
设计以下探究实验:
某一研究性学习小组做了以下实验:常温下,向某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。
[提出问题] 产生上述现象的原因是什么?
[提出猜想]
①甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至。
②乙同学认为是_____________________________。
[设计方案]
请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)。
|
实验操作 |
预期现象与结论 |
|
步骤1: |
|
|
步骤2: |
|
|
…… |
答案 ②Na2CO3水解产生的碱所致
步骤1:取适量纯碱的酚酞红色溶液于试管中
步骤2:滴加过量的BaCl2溶液
预期现象与结论:若产生白色沉淀,溶液红色完全褪去,则乙同学说法正确;若产生白色沉淀,溶液仍呈红色,则甲同学说法正确。
〖教后记〗
上一篇:第五单元 金属及其化合物(1.1)
下一篇:第五单元 金属及其化合物(1.3)
