第五单元 金属及其化合物(2.1)
2015-11-09 11:13:51 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第五单元 金属及其化合物(2.1)
|
|
|
授课人:董 啸 |
|
|
①使学生对金属的性质有一个全面的了解。 |
|
|
教学目标: |
②使学生掌握镁、铝、铁的单质及化合物的性质。 |
|
|
|
③使学生将元素化合物知识形成网络。
|
|
|
教学重点: |
铝及其化合物的两性、铁的变价及有关化学反应 |
|
|
教学难点: |
镁、铝、铁及有关化合物性质及其离子的检验 |
|
|
教学方法: |
分析比较法 |
|
|
教学过程: |
第一课时 |
|
基础知识精析
一、金属概述:
1.分类:
(1)按照密度分:轻金属(﹤4.5g/cm3)和重金属(﹥4.5g/cm3)
(2)按照颜色分:黑色金属(铁、钴、镍等金属)和有色金属(除铁、钴、镍之外的金属)
(3)按照含量分:常见金属和稀有金属
2、结构:
大多数金属最外层仅有1~2个电子,单质以金属键结合形成金属晶体。
3、性质:
(1)物理性质:不透明、有金属光泽、易导电导热、有延展性。
(2)化学性质:化学反应中只能失去电子,表现出还原性。
4、合金:
(1)定义:由两种或两种以上的金属(或金属与非金属)熔合而形成的具有金属特性的物质,叫做合金。
(2)性质:合金的熔点比各成分金属低,硬度比各成分金属大。
二、镁和铝的性质
(一)概述
1、物理性质:
共同点:都是银白色的轻金属,有较强的韧性和延展性,有良好的导电和导热性。
不同点:铝的各方面性质都比镁强,因为铝的金属键比镁的金属键强。
2、化学性质:
镁、铝为主族元素,轻金属,能自我保护。在化学反应中易失去电子表现出较强的还原性。
(二)镁及其化合物
1.镁跟非金属或氧化物反应
(1) 常温下氧化生成保护层氧化物,具有抗腐蚀的性质。
(2) 镁可以在O2、N2、SO2、CO2等氧化性气体中燃烧,生成MgO、Mg3N2、MgS和C。
镁点燃于空气中,Mg与O2、CO2和N2反应:
2Mg+O2=2MgO 2Mg+CO2=MgO+C 3Mg+N2 =Mg3N2
Mg在CO2中能够燃烧,所以活泼金属着火不能用干冰灭火器和泡沫灭火器。
(3) 镁也能跟SiO2反应:2Mg+SiO2=2MgO+Si
(4) 镁与冷水反应很慢,在加热时反应加快。
Mg+2H2O=Mg(OH)2↓+H2↑
2.镁跟酸的反应:与稀盐酸、稀硫酸等非氧化性酸发生置换反应。
Mg+2HCl=MgCl2+H2↑
3.镁与水解显酸性的盐溶液的反应
3Mg+2FeCl3+6H2O=3MgCl2+2Fe(OH)3↓+3H2↑
Mg+2NH4Cl =MgCl2+2NH3+H2↑
4.镁盐与氨水反应产生Mg(OH)2沉淀,Mg(OH)2又能溶解在NH4Cl溶液中。
前者是由Mg(OH)2的特殊溶解性决定。在常见的难溶性氢氧化物中,Mg(OH)2的溶解度最大。故产生Mg(OH)2的条件是:浓的Mg2+ 盐溶液与浓氨水反应。后者是由Mg(OH)2的电离性质和![]() 的水解性质决定。通常简单认为Mg(OH)2完全电离,故能溶解在饱和NH4Cl溶液中。
的水解性质决定。通常简单认为Mg(OH)2完全电离,故能溶解在饱和NH4Cl溶液中。
MgCl2+2NH3·H2O![]() Mg(OH)2+2NH4Cl
Mg(OH)2+2NH4Cl
5.镁的冶炼:
海水中提Mg:镁在海水中含量居第三位,总量达2100万亿吨。目前镁世界总产量约300万吨。
(1) 把从海水提取出食盐、KCl、Br2以后留下的母液浓缩,就得到卤块,主要成分是MgCl2·6H2O。
(2) 脱水 MgCl2·6H2O![]() MgCl2+6H2O
MgCl2+6H2O
(3) 电解
海水![]() Mg(OH)2
Mg(OH)2 ![]() MgO
MgO![]() MgCl2
MgCl2![]() Mg
Mg
6.镁的化合物
(1) 氧化镁:白色粉末,高熔点(2800℃),碱性氧化物,能与酸反应。
MgO+2HCl=MgCl2+H2O
(2) 氢氧化镁:白色粉末,难溶于水,与H+作用,与NH4Cl溶液作用,热不稳定性。
Mg(OH)2+2HCl=MgCl2+2H2O Mg(OH)2![]() MgO+H2O↑
MgO+H2O↑
(三)铝及其化合物
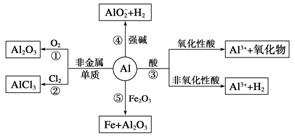
1.铝跟非金属反应
铝在空气中强热:4Al+3O2![]() 2Al2O3 2Al+N2
2Al2O3 2Al+N2![]() 2AlN
2AlN
铝容易和卤素反应,常温下和氯气激烈化合生成三氯化铝。在高温下也能和硫、氮气、碳直接化合成Al2S3、AlN、Al4C3(2000℃)。
思考题:铝是活泼金属,为什么铝制品常用来作为各种材料、具有一定的防腐蚀能力?
2.铝跟水反应
常温下不与水反应,铝与沸水反应(但有保护层则不反应。)
2Al+6H2O![]() 2Al(OH)3↓+3H2↑
2Al(OH)3↓+3H2↑
3.铝与酸反应
(1) 与非氧化性强酸(稀硫酸、盐酸)反应
2Al+3H2SO4=Al2(SO4)3+3H2↑ 2Al+6H+ =2Al3++3H2↑
(2) 常温下,铝、铁遇浓硫酸、浓硝酸发生钝化。高纯度的铝(含99.950%铝)不与一般酸反应,只溶于王水。
(3)铝与热浓硫酸、浓硝酸反应:
2Al+6H2SO4(浓)![]() Al2(SO4)3+3SO2↑+6H2O
Al2(SO4)3+3SO2↑+6H2O
(4) 铝与稀硝酸反应不产生H2 Al+HNO3(稀) → ?
4.铝与强碱溶液反应
表面氧化膜:Al2O3+2NaOH![]() 2NaAlO2+H2O
2NaAlO2+H2O
2Al+6H2O=Al(OH)3↓+3H2↑
Al(OH)3+NaOH=NaAlO2+2H2O
总反应:2Al+2NaOH+6H2O = 2NaAlO2+3H2↑+4H2O
简化:2Al+2NaOH+2H2O = 2NaAlO2+3H2↑
反应中,H2O是氧化剂,Al是还原剂,H2O作氧化剂时,只有氢离子得电子,所以1 mol H2O只能获得1 mol电子,所以反应中电子转移的方向和数目可表示为:

注意:① 在中学化学中,除两个碱Cu(OH)2、Ag(NH3)2OH在有机反应中作弱氧化剂外,其余碱都不作氧化剂。
②等量的铝与过量的酸或过量的碱溶液反应,产生相同量的氢气。
【方法与技巧】铝与酸、碱反应生成H2的量的关系
铝与酸、碱反应的化学方程式分别为2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑。从化学方程式可以看出Al与酸、碱反应时生成H2的实质都是AlAl3+,所以无论与酸还是与碱反应,Al与H2的关系都是2Al~3H2。
①等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气体积比=1∶1。
②足量的铝分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比=1∶3。
③一定量的铝分别与一定量的盐酸和氢氧化钠溶液反应,产生氢气的体积比<<,则必定是a.铝与盐酸反应时,铝过量而盐酸不足;b.铝与氢氧化钠反应时,铝不足而氢氧化钠过量。解题时应充分利用上述过量关系。
铝的这种既能与酸(非氧化性酸)又能与强碱反应产生H2的性质常作为推断题的“题眼”。
【思考与交流】
①铝与酸、碱反应的实质是什么?氧化剂是什么?
②等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是多少?为什么?
③足量的两份铝分别投入到等体积、等物质的量浓度的盐酸、氢氧化钠溶液中,产生H2的体积关系是什么?为什么?
④足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度是什么关系?为什么?
例题1、(2011·太原调研)等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5∶6,则甲、乙两烧杯中的反应情况可能分别是( )
A.甲、乙中都是铝过量 B.甲中铝过量、乙中碱过量
C.甲中酸过量、乙中铝过量 D.甲中酸过量、乙中碱过量
例题2、甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为( )
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
5.铝热反应
铝能从许多氧化物中夺氧,所以铝是冶金上常用的还原剂。铝热反应、铝热剂、金属热还原法,用以冶炼Ni、Mn、V等难熔金属。
2Al+Fe2O3![]() Al2O3+2Fe 10Al+3V2O5
Al2O3+2Fe 10Al+3V2O5![]() 5Al2O3+6V
5Al2O3+6V
8Al+3Co3O4![]() 4Al2O3+9Co 8Al+3Fe3O4
4Al2O3+9Co 8Al+3Fe3O4![]() 4Al2O3+9Fe
4Al2O3+9Fe
铝是炼钢的脱氧剂:2Al+3FeO![]() 3Fe+Al2O3
3Fe+Al2O3
![]() 深度思考
深度思考![]()
1.铝的化学性质活泼,为什么日常生活中广泛使用的铝制品通常具有较好的抗腐蚀性能?
答案 铝在常温下迅速被氧气氧化,形成一层致密的氧化膜,保护铝不再被氧化,因而铝制品通常具有较强的抗腐蚀性能。
2.金属铝是活泼的金属,能与酸反应,为什么能用铝槽储运浓H2SO4或浓HNO3?
答案 常温下浓H2SO4、浓HNO3能使铝钝化(在表面形成一层致密的氧化膜),阻止反应继续进行。
3.实验室能否用硫化物与铝盐溶液混合制取Al2S3?用离子方程式说明原因。
答案:不能,Al3+和S2-在水溶液中发生双水解反应:2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑。
4.Al既能溶于强酸,又能溶于强碱,所以说“Al既有金属性,又有非金属性”你认为这种说法是否恰当?为什么?
答案:不恰当。金属性是指元素的原子失电子的能力,非金属性是指元素的原子得电子的能力。铝不论是与酸反应还是与碱反应,都是失去3e-化合价升高为+3价,均是还原剂,因而铝具有较强的金属性。
题组一 铝的化学性质及应用
1.1989年世界卫生组织把铝确定为食品污染源之一,加以控制使用,铝在下列应用时应加以控制的是 ( )
①制铝合金 ②制电线 ③制炊具 ④明矾净水 ⑤明矾和苏打制食品膨松剂 ⑥用氢氧化铝凝胶制胃舒平药品 ⑦银色漆颜料 ⑧制易拉罐 ⑨包装糖果和小食品
A.全部 B.③⑤⑧⑨ C.⑥⑧⑨ D.③④⑤⑥⑧⑨
答案 D 解析:“D”中所涉及的铝易进入食品、饭、水等,并被人体吸收,所以要加以控制。
2.下列关于铝的叙述中正确的是 ( )
A.铝还原性强且亲氧性强,所以可通过铝热反应冶炼高熔点金属
B.铝在空气中极易锈蚀,所以铝制品的使用时间很短
C.铝能耐稀硫酸腐蚀,所以运送稀硫酸可用铝制槽车
D.铝的导电性比铜、银更强,所以常用以制造电线、电缆
答案 A解析 铝在空气中形成致密的氧化膜,保护内层不被氧化,B错;铝不能耐稀硫酸腐蚀,C错;铝的导电性不如铜、银,D错。
3.常温下把铝粉加入下列物质中,能产生氢气的是 ( )
A.硫酸钠溶液 B.稀硝酸 C.浓硫酸 D.氯化铵溶液
答案 D 解析:硫酸钠溶液呈中性,与Al不反应,A项不能产生H2;稀硝酸具有强氧化性,B项不能产生H2;常温下铝粉在浓硫酸中钝化,C项不能产生H2;D项中NH水解,溶液呈酸性,加入铝粉时,Al与H+反应产生H2。
题组二 对比掌握铝、镁的性质
4.镁、铝都是较活泼的金属,下列描述中正确的是 ( )
A.高温下,镁、铝在空气中都有抗腐蚀性
B.镁、铝都能跟稀盐酸、稀硫酸、强碱反应
C.镁在点燃条件下可以与二氧化碳反应,铝在一定条件下可以与氧化铁发生氧化还原反应
D.铝热剂是镁条、铝粉和氧化铁的混合物
答案 C 解析 在常温下,镁和铝在空气里都能与氧气反应,生成一层致密而坚固的氧化物薄膜,这层氧化物薄膜能够阻止金属的继续氧化,所以镁和铝都有抗腐蚀的性能,但是在高温下能与氧气剧烈反应,放出大量热,A错;镁能跟酸反应,不能跟碱反应,B错;铝热剂是铝粉和氧化铁的混合物。在进行铝热反应时,为了引燃,在铝热剂上放供氧剂(氯酸钾),中间插一根镁条,是引燃用的,D错。
5.将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 ( )
A.3 mol·L-1 HCl B.4 mol·L-1 HNO3
C.8 mol·L-1 NaOH D.18 mol·L-1 H2SO4
答案 A 解析 在镁、铝混合物中加入HNO3和浓H2SO4都不产生H2;加入NaOH溶液,只有Al与之反应生成H2,而镁不反应;加入盐酸,镁、铝都与盐酸反应生成H2,所以放出H2的量最多。
铝和某些金属氧化物反应,将其从氧化物中置换出来,同时放出大量的热,这种反应称为铝热反应,可用于焊接金属、冶炼高熔点贵重金属。
注意 Al与MgO不能发生铝热反应。
题组三 从定性和定量的角度理解铝与酸、碱反应的实质
6.铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质回答下列问题:
(1)铝与酸、碱反应的实质是什么?氧化剂是什么?
答案 铝与酸、碱反应的实质都是: Al3+,2H+H2,只不过碱中的H+来源于水的电离,氧化剂分别为酸和水。
(2)区别镁和铝最好的方法是取少量试样,然后 ( )
A.投入沸水中 B.投入冷水中 C.投入盐酸 D.投入NaOH溶液中
答案 D
(3)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。
答案 1∶1 解析 根据化学方程式:2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑得Al与H2的关系式均为2Al~3H2,故只要参加反应的Al相等,所得H2必相等。
(4)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸、氢氧化钠溶液中,产生H2的体积之比是________。
答案:1∶3 解析:因为在反应中Al过量,产生的H2由HCl和NaOH的量决定。根据化学反应中的关系式:6HCl~3H2;2NaOH~3H2,故当HCl、NaOH物质的量相等时,二者产生H2的体积比为1∶3。
(5)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是________。
答案 3∶1
解析:因为铝足量且产生H2相等,根据关系式n(HCl)∶n(NaOH)=3∶1,又因为两溶液体积相等,故物质的量浓度c(HCl)∶c(NaOH)=n(HCl)∶n(NaOH)=3∶1。
(6)甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为 ( )
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
答案 A
解析:其反应原理分别为2Al+6HCl===2AlCl3+3H2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑。可见当参加反应的HCl和NaOH的物质的量一样多时,产生H2的体积比是1∶3,而题设条件体积比为1∶2,说明此题投入的铝粉对盐酸来说是过量的,而对于NaOH来说是不足的。
2Al+6HCl === 2AlCl3+3H2↑
6 mol 3 mol
3 mol·L-1×0.1 L 0.15 mol
则Al与NaOH反应生成的H2为0.15 mol×2=0.3 mol。
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2×27 g 3 mol
5.4 g 0.3 mol
即投入的铝粉为5.4 g。
6.铝的化合物
(1) 氧化铝:白色固体,高熔点(2045℃),难溶于水,两性氧化物。
① 与酸反应
Al2O3+6HCl=2AlCl3+3H2O Al2O3+3H2SO4=Al2(SO4)3+3H2O
② 与强碱溶液反应
Al2O3+2NaOH=2NaAlO2+H2O
③电解氧化铝:2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
(2) 氢氧化铝:白色固体,难溶于水,受热可分解。
① 与酸反应
Al(OH)3+3HCl=AlCl3+3H2O 2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
Al(OH)3+3HNO3=Al(NO3)3+3H2O
② 与强碱溶液反应
Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+KOH=KAlO2+2H2O
③ 氢氧化铝的热分解
2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
④制备方法:
铝盐与氨水反应: Al3++3NH3·H2O===Al(OH)3↓+3NH
NaAlO2溶液中通入足量CO2:AlO+CO2+2H2O===Al(OH)3↓+HCO
NaAlO2溶液与AlCl3溶液混合:3AlO+Al3++6H2O===4Al(OH)3↓
(3)硫酸铝钾[KAl(SO4)2]
明矾[KAl(SO4)2·12H2O]:无色晶体,易溶于水;
一种复盐:KAl(SO4)2 = K+ + Al3+ + SO42—;
易水解:Al3+ + 3H2O = Al(OH)3 + 3H+;
主要用途:净化水。
7.铝的冶炼:
铝土矿(主要成分Al2O3) ![]() Al2O3
Al2O3 ![]() Al
Al
问题:怎样从铝土矿提出纯净的Al2O3?电解Al2O3时为什么加冰晶石?电解中阳极为什么会消耗?
【思维建模】
题组一 Al2O3、Al(OH)3溶于酸或碱相关考查
1.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
答案 C
解析 钝化的实质是Fe、Al在浓H2SO4或浓HNO3作用下其表面被氧化成一层致密的氧化物保护膜。由于铝的氧化物Al2O3,是一种两性氧化物,既可与强酸反应,又可与强碱反应,故A、B、D三项皆不符合题意,只有C选项中的Cu(NO3)2不与Al2O3反应,故不可能与钝化的铝条发生反应。
2.铝、氧化铝、氢氧化铝和可溶性铝盐与过量强碱溶液的反应,其生成物有一定的规律,下列说法中正确的是 ( )
A.都有H2O生成 B.都有H2生成
C.都有AlO生成 D.都有Al3+生成
答案 C
题组二 两性物质及其应用
3.下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是 ( )
①NaHCO3 ②(NH4)2SO3 ③Al2O3 ④Al(OH)3 ⑤Al
A.全部 B.只有①③④⑤ C.只有③④⑤ D.只有②③④⑤
答案 A
解析 弱酸的酸式盐、弱酸弱碱盐、Al、Al2O3、Al(OH)3等物质既可与强酸反应又可与强碱反应,故选A。
4.小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.5 g NaHCO3,2片小苏打片和胃酸完全中和,被中和的H+是____ mol。
(2)胃舒平每片含0.245 g Al(OH)3。中和胃酸时,6片小苏打片相当于胃舒平_____片。
(3)达喜的化学成分是铝和镁的碱式盐,其化学式为Al2Mg6(OH)16CO3·4H2O。1 mol达喜分别与足量的盐酸和NaOH溶液反应,消耗盐酸和NaOH的物质的量之比为________。
答案 (1)0.012 (2)3.8 (3)9∶2
解析 (1)2片小苏打所含NaHCO3的质量为1 g,其物质的量为=0.012 mol,由HCO+H+===CO2↑+H2O,可知n(H+)=0.012 mol。
(2)6片小苏打的物质的量为,即中和的H+为 mol,而每片的Al(OH)3的物质的量为,由Al(OH)3+3H+===Al3+3H2O,所以Al(OH)3的片数为=3.8片。
(3)Al2Mg6(OH)16CO3·4H2O与足量的盐酸反应时,最终产物为AlCl3和MgCl2,依据电荷守恒和原子守恒可得如下关系式:
Al2Mg6(OH)16·4H2O~2AlCl3+6MgCl2~18HCl
因而1 mol达喜消耗HCl的最大物质的量为18 mol。由于Al(OH)3可溶于NaOH,生成NaAlO2,Mg(OH)2不溶于NaOH,且溶解度比MgCO3的小,故达喜与足量NaOH反应后的最终产物为NaAlO2、Mg(OH)2和Na2CO3。依据钠原子守恒可知1 mol达喜消耗NaOH的最大量为4 mol。
题组三 关于Al(OH)3的制备的最佳途径
5.Al(OH)3是治疗胃酸过多的药物胃舒平的主要成分。某课外兴趣小组用铝、稀硫酸、烧碱为原料,制备一定量的Al(OH)3。他们分别设计了两种实验方案:
方案一:AlAl2(SO4)3Al(OH)3
方案二:AlNaAlO2Al(OH)3
(1)从节约药品的角度思考,你认为哪一种方案较好?_____,方案一和方案二共同存在的问题是________________________________。
(2)请用相同的原料设计一个更为节约药品的方案,并写出有关反应的化学方程式:_________________________________________________。
答案 (1)方案二较好 第二步操作很难控制试剂用量
(2)2Al+3H2SO4===Al2(SO4)3+3H2↑;2Al+2NaOH+2H2O===2NaAlO2+3H2↑;Al3++3AlO+6H2O===4Al(OH)3↓
6.若甲、乙、丙三位同学用规定的药品制备Al(OH)3。规定必用的药品如下:350 g 70% H2SO4溶液,NaOH固体240 g,足量铝屑、水(不能用其他药品)。
甲、乙、丙用各自设计的方案制得Al(OH)3的质量分别是W1、W2、W3。三种实验方案如下:
甲:铝→加NaOH溶液→加H2SO4溶液→W1 g Al(OH)3
乙:铝→加H2SO4溶液→加NaOH溶液→W2 g Al(OH)3
丙:→W3 g Al(OH)3
试回答:(1)从充分利用原料、降低成本和提高产率等因素分析,实验方案最合理的是____。
(2)三位学生制得的Al(OH)3,W1、W2、W3其质量由大到小的顺序是_______。
(3)制得Al(OH)3的最大质量是________。
答案 (1)丙 (2)W3>W1>W2 (3)520 g
【小贴士】既能与强酸反应,又能与强碱反应的物质:
(1) 某些金属 如:Al、Zn
(2) 两性氧化物 如:Al2O3、ZnO
(3) 两性氢氧化物 如:Al(OH)3、Zn(OH)2
(4) 弱酸的酸式盐 如:NaHCO3、NaHS、NaHSO3、Na2HPO4、NaH2PO4
(5) 弱酸的铵盐 如:(NH4)2S、(NH4)2CO3、(NH4)2SO3、NH4HS等。
(6)氨基酸 如:H2N-CH2-COOH
〖教后记〗
上一篇:第五单元 金属及其化合物(1.3)
下一篇:第五单元 金属及其化合物(2.2)
