第四单元 离子反应(1)
2015-11-09 10:54:05 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第四单元 离子反应(1)
|
|
|
授课人:董 啸 |
|
|
①了解电解质和非电解质、强电解质和弱电解质的概念。 |
|
|
教学目标: |
②理解离子反应的概念。 |
|
|
|
③掌握离子方程式的书写和判断正误的方法。 |
|
|
教学重点: |
离子方程式的书写和判断正误的方法、离子共存的判断 |
|
|
教学难点: |
离子方程式的书写和判断正误的方法、离子共存的判断 |
|
|
教学方法: |
分析比较法 |
|
|
教学过程: |
第一课时 |
|
基础知识精析
一、基本概念
1.电解质和非电解质,强电解质和弱电解质概念
①电解质是指在水溶液中或熔融状态下能导电的化合物;
②非电解质是指无论在水溶液或熔融状态都不能导电的化合物。
说明:无机物中,酸、碱、大部分盐都是电解质,金属氧化物大部分都是电解质,非金属氧化物都是非电解质。通常情况下的气体化合物除卤化氢、H2S为电解质外,其他大多是非电解质。有机化合物大多是非电解质。
注意:单质、溶液、NH3、CO2、SO2等不属于电解质。
③在水溶液里全部电离成离子的电解质叫做强电解质。强酸、强碱和大多数盐是强电解质;强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI等;强碱:KOH、NaOH、Ba(OH)2等;绝大部分盐:BaSO4、BaCl2等。
④只有部分分子电离成离子的电解质叫做弱电解质。弱酸、弱碱是弱电解质。
弱酸:CH3COOH、HCN、H2S、H2CO3等;弱碱:NH3·H2O、Cu(OH)2等H2O及小部分盐:(CH3COO)2Pb、HgCl2等;
说明:在水溶液中或熔融状态下能电离的化合物是电解质,不能电离的化合物是非电解质,全部电离的化合物是强电解质,部分电离的化合物是弱电解质。
⑤离子导电能力比较:离子浓度越大,所带电荷越多,导电能力越强。
说明:a.电解质溶液导电属于化学变化;
b.溶液浓度相同的溶液导电能力不一定相同;
c.等浓度的盐酸和醋酸相比盐酸的导电能力强;等pH值的盐酸和醋酸相比盐酸的导电能力相同;等浓度的盐酸和醋酸等体积稀释后盐酸的导电能力弱。
【思考与交流】
1.固体食盐不导电,它是电解质吗?盐酸和金属铜都能够导电,是电解质吗?是非电解质吗?为什么?
2.CO2、NH3、SO3的水溶液能够导电,为什么它们不是电解质呢?
3.强电解质的饱和溶液导电能力一定很强吗?一定比弱电解质溶液导电能力强吗?影响溶液导电性强弱的因素有哪些?
4.AgCl、BaSO4、CaCO3等均难溶于水,它们是弱电解质吗?CH3CH2OH、CH3COOH等均易溶于水,它们是强电解质吗?试总结电解质的强弱与其溶解性的关系。
5.(1)NaHSO4和NaHCO3在水溶液中的电离方程式相同吗?
(2)NaHSO4在水溶液中和在熔融状态下的电离相同吗?写出电离方程式。
【深度思考![]() 】
】
1. 某物质溶于水所得的溶液能导电,该物质一定是电解质吗?
答案:不一定,如Cl2的水溶液能导电,但它不是化合物,所以它既不是电解质,也不是非电解质。CO2、SO2、NH3的水溶液也能导电,但导电的原因并不是CO2、SO2、NH3分子的电离所致,而是它们与水反应生成的H2CO3、H2SO3、NH3·H2O电离产生自由移动的离子所致,故CO2、SO2、NH3是非电解质。
2.某物质的水溶液导电性很强,该物质一定是强电解质吗?
答案:不一定,电解质的强弱与溶液的导电性没有必然联系。溶液导电性强弱取决于溶液中自由移动离子浓度的大小及离子所带电荷数的多少,稀的强电解质溶液导电性很弱,浓度较大的弱电解质溶液导电性可能比较强。
3. 下列物质中,属于电解质的是________,属于非电解质的是________;属于强电解质的是________,属于弱电解质的是________。
①硫酸 ②盐酸 ③氯气 ④硫酸钡 ⑤酒精 ⑥铜 ⑦醋酸 ⑧氯化氢 ⑨蔗糖 ⑩氨气 ⑪CO2 ⑫NaHCO3
答案:①④⑦⑧⑫ ⑤⑨⑩⑪ ①④⑧⑫ ⑦
4. 判断正误,正确的划“√”,错误的划“×”
(1)强电解质溶液的导电性比弱电解质溶液的导电性强 ( )
(2)BaSO4投入水中, 导电性较弱,故它是弱电解质 ( )
(3)弱电解质溶液中存在两种共价化合物分子 ( )
(4)强电解质都是离子化合物,弱电解质都是共价化合物 ( )
答案 (1)× (2)× (3)√ (4)×
解析 电解质溶液导电性的强弱与溶液中离子浓度的大小及所带电荷数的多少有关,与电解质强弱没有必然联系,(1)错误;尽管BaSO4难溶于水,但溶解的部分全部电离,故其为强电解质,(2)错误;弱电解质溶液中,有未电离的弱电解质和水这两种共价化合物分子,(3)正确;HCl、H2SO4都是共价化合物但却是强电解质,(4)错误。
题组一 电离方程式的书写——理解离子反应的基石
1. 写出下列典型物质的电离方程式
(1)H2SO4____________________________________________________;
(2)H2CO3____________________________________________________;
(3)Ca(OH)2___________________________________________________;
(4)Fe(OH)3___________________________________________________;
(5)NH3·H2O__________________________________________________;
(6)NaCl______________________________________________________;
(7)BaSO4_____________________________________________________;
(8)NaHSO4___________________________________________________;
(9)NaHCO3___________________________________________________;
(10)NaHSO4(熔融)_____________________________________________;
(11)Al2O3(熔融)_____________________ __________________________。
答案:(1)H2SO4===2H++SO
(2)H2CO3![]()
![]() H++HCO、HCO
H++HCO、HCO![]()
![]() H++CO
H++CO
(3)Ca(OH)2===Ca2++2OH- (4)Fe(OH)3![]()
![]() Fe3++3OH-
Fe3++3OH-
(5)NH3·H2O![]()
![]() NH+OH- (6)NaCl===Na++Cl-
NH+OH- (6)NaCl===Na++Cl-
(7)BaSO4===Ba2++SO (8)NaHSO4===Na++H++SO
(9)NaHCO3===Na++HCO、HCO![]()
![]() H++CO
H++CO
(10)NaHSO4Na++HSO (11)Al2O32Al3++3O2-
2. 下列物质在指定条件下电离方程式正确的是 ( )
A.Na2CO3溶于水 Na2CO3===Na+CO
B.Al(OH)3酸式电离 Al(OH)3===H++AlO+H2O
C.NaHS溶于水HS-的电离 HS-+H2O![]()
![]() H2S+OH-
H2S+OH-
D.NaHCO3加热熔化 NaHCO3===Na++HCO
答案 D
题组二 溶液导电性变化的分析
3. 在如下图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是 ( )
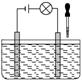
A.盐酸中逐滴加入食盐溶液 B.醋酸中逐滴加入氢氧化钠溶液
C.饱和石灰水中不断通入CO2 D.醋酸中逐滴加入氨水
答案 C
4. 将四份2 g NaOH固体分别放入100 mL下列溶液中,等足够长时间后(不计水分挥发),溶液的导电能力变化不大的是 ( )
A.自来水 B.0.5 mol·L-1 HCl溶液
C.0.5 mol·L-1 CH3COOH溶液 D.0.5 mol·L-1 NaCl溶液
答案 B
5. 同一温度下,强电解质溶液a,弱电解质溶液b,金属导体c三者的导电能力相同,若升高温度后,它们的导电能力强弱顺序是 ( )
A.b>a>c B.a=b=c C.c>a>b D.b>c>a
答案 A
解析 金属导体随温度升高导电能力减弱;强电解质不存在电离平衡,升高温度,溶液中的离子浓度不变,但导电能力随温度的升高而增强;弱电解质存在着电离平衡,升高温度,弱电解质的电离程度增大,溶液中的离子浓度增大,随温度的升高,弱电解质的导电能力增加得最快。
归纳总结:金属导电与电解质溶液导电原因对比
1.金属导电是由于自由电子在电场作用下的定向移动,温度高、金属阳离子振动幅度大,自由电子定向移动阻力增大,金属导电性变弱。
2.电解质溶液之所以导电,是由于溶液中有自由移动的离子存在。电解质溶液导电能力的大小,决定于溶液中自由移动离子的浓度和离子的电荷数,和电解质的强弱没有必然联系。但温度升高时弱电解质电离程度增大、离子浓度增大、导电性会增强。
2.离子反应
(1)离子反应:在溶液(或熔融状态)有离子参加或生成的反应叫离子反应。
(2)离子反应的实质:反应物中某些离子浓度变化。
离子反应的发生会引起离子种类或物质的量的变化。因此在质量守恒前提下,离子物质的量或种类发生了变化,离子反应就发生了。
(3)离子反应的类型
①非氧化还原型:酸、碱、盐之间的复分解反应;碱性氧化物和酸,酸性氧化物和碱的反应;电离反应,水解反应。
②氧化还原型:溶液中的置换反应;溶液中的氧化还原反应;电极反应,电解反应。
(4)离子反应发生的条件
①生成难溶物;②生成难电离物质;③生成气体或易挥发性物质;④离子间发生氧化还原反应。
二.离子反应方程式
1、定义:
用实际参加反应的离子符号表示化学反应的式子叫做离子反应方程式。
2、书写方法:
“写”:写出反应的化学方程式;
“改”:把易溶且易电离的物质改写成离子形式;
“删”:删去未参加反应的离子;
“查”:检查方程式是否遵守质量守恒和电荷守恒。
【小贴士】①一步到位易出错,按部就班不易错。②微溶物质应根据实际情况决定形式;氧化物在离子方程式中不能拆开写。③有些反应不能写离子方程式,如铜或食盐与浓硫酸反应、氯化铵与碱石灰反应等。④与量有关的反应应特别注意“少定多变”原则:少则为一,多则够用。
【活学活用】
写出以下反应的离子方程式。
①NaHCO3与过量Ba(OH)2反应 ②NaHCO3与少量Ba(OH)2反应
③NaOH与过量Ba(HCO3)2反应 ④NaOH与少量Ba(HCO3)2反应
⑤将NaOH逐滴加入AlCl3中 ⑥将AlCl3逐滴加入NaOH中
⑦少量CO2与苯酚钠反应 ⑧硫酸和氢氧化钡反应
【思考与交流】
1、硫酸氢钠与氢氧化钡溶液在不同用量时反应的离子方程式?
2、明矾与氢氧化钠溶液在不同用量时反应的离子方程式?
3、分别写出少量Cl2与FeBr2反应、过量Cl2与FeBr2反应、等量Cl2与FeBr2反应的离子方程式。
补充:Cl2与FeI2反应的三种情况的方程式。
![]() 深度思考
深度思考![]()
1. 写出下列典型反应的离子方程式:
(1)氯化铝溶液中加入过量氨水__________________________________。
(2)小苏打与乙酸溶液混合______________________________________。
(3)氧化镁溶于稀硫酸__________________________________________。
(4)澄清石灰水中加入盐酸______________________________________。
(5)Cl2通入水中_______________________________________________。
(6)明矾溶于水发生水解________________________________________。
(7)实验室用浓盐酸与MnO2共热制Cl2____________________________。
(8)在石灰乳中加入Na2CO3溶液_________________________________。
(9)NH4Cl溶液与NaOH溶液混合________________________________。
(10)浓HNO3与Cu的反应______________________________________。
(11)浓H2SO4与Cu混合加热____________________________________。
(12)(NH4)2SO4溶液与NaOH溶液混合加热________________________。
(13)Na2SO4溶液与AgNO3溶液混合________________________。
(14)NaHCO3溶液与稀盐酸混合______________________________。
(15)NaHSO4溶液与NaOH溶液混合__________________________。
答案 (1)Al3++3NH3·H2O===Al(OH)3↓+3NH
(2)HCO+CH3COOH===CH3COO-+CO2↑+H2O
(3)MgO+2H+===Mg2++H2O
(4)OH-+H+===H2O
(5)Cl2+H2O![]()
![]() H++Cl-+HClO
H++Cl-+HClO
(6)Al3++3H2O![]()
![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
(7)4H++2Cl-+MnO2Cl2↑+2H2O+Mn2+
(8)Ca(OH)2+CO===CaCO3+2OH-
(9)NH+OH-===NH3·H2O
(10)Cu+4H++2NO===Cu2++2NO2↑+2H2O
(11)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(12)NH+OH-NH3↑+H2O
(13)SO+2Ag+===Ag2SO4↓
(14)HCO+H+===H2O+CO2↑
(15)H++OH-===H2O
2.下列离子方程式中,只能表示一个化学反应的是________。
①Fe+Cu2+===Fe2++Cu
②Ba2++2OH-+2H++SO===BaSO4↓+2H2O
③Cl2+H2O![]()
![]() H++Cl-+HClO
H++Cl-+HClO
④CO+2H+===CO2↑+H2O
⑤Ag++Cl-===AgCl↓
答案 ③
题组一 多重反应离子方程式的书写
1.完成下列反应的离子方程式:
(1)Ba(OH)2溶液与(NH4)2SO4溶液混合:____________________。
(2)CuSO4溶液与Ba(OH)2溶液混合:_______________________。
(3)NH4HCO3与过量NaOH溶液混合:________________________。
(4)Ba(OH)2与H2SO4两稀溶液混合:__________________________。
(5)Fe2O3溶于HI溶液中:________________________________。
(6)FeBr2溶液中通入过量Cl2:__________________________。
(7)FeO溶于稀HNO3中:__________________________________。
答案 (1)Ba2++2OH-+2NH+SO===BaSO4↓+2NH3·H2O
(2)Cu2++SO+Ba2++2OH-===BaSO4↓+Cu(OH)2↓
(3)NH+HCO+2OH-===NH3·H2O+CO+H2O
(4)Ba2++2OH-+2H++SO===BaSO4↓+2H2O
(5)Fe2O3+6H++2I-===2Fe2++3H2O+I2
(6)2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
(7)3FeO+10H++NO===3Fe3++NO↑+5H2O
题组二 酸式盐与碱反应离子方程式的书写
2. NaHCO3溶液与Ca(OH)2溶液反应
(1)NaHCO3少量_________________________________;
(2)NaHCO3足量__________________________________。
答案 (1)HCO+OH-+Ca2+===CaCO3↓+H2O
(2)Ca2++2OH-+2HCO===CaCO3↓+CO+2H2O
3. Ca(HCO3)2溶液与NaOH溶液反应
(1)Ca(HCO3)2少量____________________________________;
(2)Ca(HCO3)2足量____________________________________。
答案 (1)Ca2++2HCO+2OH-===CaCO3↓+CO+2H2O
(2)OH-+HCO+Ca2+===CaCO3↓+H2O
4. Ca(HCO3)2溶液和Ca(OH)2溶液反应
(1)Ca(HCO3)2少量_______________________________________;
(2)Ca(HCO3)2足量________________________________________。
答案 (1)Ca2++HCO+OH-===CaCO3↓+H2O
(2)Ca2++HCO+OH-===CaCO3↓+H2O
思维建模:“定一法”书写酸式盐与碱反应的离子方程式
(1)根据相对量将少量物质定为“1 mol”,若少量物质有两种或两种以上离子参加反应,则参加反应离子的物质的量之比与物质组成比相符。
(2)依据少量物质中离子的物质的量,确定过量物质中实际参加反应的离子的物质的量。
(3)依据“先中和后沉淀”的思路正确书写离子方程式。
〖教后记〗
上一篇:第3单元 氧化还原反应.ppt
下一篇:第四单元 离子反应(2)
