第十三单元 化学实验(4)
2015-12-01 08:34:34 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第十三单元 化学实验(4)
|
|
|
授课人:董 啸 |
|
|
①了解一般事故处理方法,能对常见物质进行检验、分离和提纯。
|
|
|
教学目标: |
②了解实验室常用仪器的主要用途和用法,能根据要求配制溶液。
|
|
|
|
③掌握化学实验的基本操作,掌握常见气体的实验室制法。 |
|
|
教学重点: |
物质的制备、检验、分离提纯 |
|
|
教学难点: |
设计、评价或改进实验方案 |
|
|
教学方法: |
分析比较法 |
|
|
教学过程: |
第四课时 |
|
基础知识精析
三、物质检验
物质的检验通常有鉴定、鉴别和推断三类,它们的共同点是:依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理。
鉴定通常是指对于某一种物质的定性检验,根据物质的化学特性,分别检出阳离子、阴离子。
鉴别通常是指对分别存放的两种或两种以上的物质进行定性辨认,可根据一种物质的特性区别于另一种,也可根据几种物质的颜色、气味、溶解性、溶解时的热效应等一般性质的不同加以区别。
推断是通过已知实验事实,根据性质分析推求出被检验物质的组成和名称。
1、常见离子检验
H+、K+、Na+、Mg+、Al3+、NH4+、Fe3+、Fe2+、Ag+、Ba2+、Cu2+
OH-、Cl-、Br-、I-、S2-、SO42-、SO32-、CO32-、HCO3-、NO3-
【学法指导】离子检验的方法:
原理:少量样品中加入某种试剂,产生特殊现象(沉淀、气体或颜色变化等),说明含有某种离子。
要求:试剂常见;反应迅速;现象明显且独特。
H+:能使紫色石蕊试液或橙色的甲基橙试液变为红色。
Na+、K+ :用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过钴玻片)。
Ba2+:能使稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸。
Mg2+ :能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液。
Al3+:能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。
Ag+:能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀 HNO3。Ag+中逐滴加入于氨水,先产生白色沉淀后沉淀消失,生成[Ag(NH3)2]OH。
NH4+:铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体。
Fe2+:能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色。2Fe2++Cl2=2Fe3++2Cl-
Fe3+:能与 KSCN溶液反应,变成血红色Fe(SCN)3溶液;能与 NaOH溶液反应,生成红褐色Fe(OH)3沉淀;与苯酚反应呈紫色。
Cu2+:蓝色水溶液(浓的CuCl2溶液显绿色),能与NaOH溶液反应,生成蓝色的Cu(OH)2沉淀。
OH- :能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄色。
Cl-:能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸。
Br-:能与硝酸银反应,生成淡黄色AgBr沉淀,不溶于稀硝酸。
I-:能与硝酸银反应,生成黄色AgI沉淀,不溶于稀硝酸;也能与氯水反应,生成I2,使淀粉溶液变蓝。
SO42-:能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于硝酸。
SO32-:浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液(溴水、酸性高锰酸钾)褪色。能与BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体。
CO32-:能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水变浑浊的CO2气体。
HCO3- :取含HCO3-盐溶液煮沸,放出无色无味CO2气体,气体能使澄清石灰水变浑浊。或向HCO3-盐酸溶液里加入稀MgSO4溶液,无现象,加热煮沸,有白色沉淀 MgCO3生成,同时放出 CO2气体。
【归纳总结】无色溶液中离子检验的一般思路
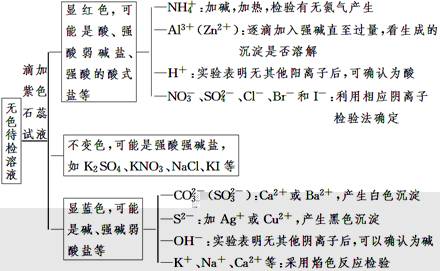
2、几种重要物质的检验
①常见气体的检验方法
(1)氢气:纯净的氢气在空气中燃烧呈淡蓝色火焰,混合空气点燃有爆鸣声,生成物只有水。不是只有氢气才产生爆鸣声;可点燃的气体不一定是氢气。
(2)氯气:黄绿色,能使湿润的碘化钾淀粉试纸变蓝(O3、NO2也能使湿润的碘化钾淀粉试纸变蓝)。
(3)氧气:可使带火星木条复燃。
(4)氯化氢:无色有刺激性气味,潮湿的空气中能形成白雾,遇浓氨水冒白烟。能使湿润的蓝色石蓝试纸变红;将气体通入AgNO3溶液时有白色沉淀生成。
(5)二氧化硫:无色有刺激性气味,使品红溶液褪色,加热后又显红色。能使酸性高锰酸钾溶液褪色。
(6)硫化氢:无色有臭鸡蛋气味,使湿润的Pb(AC)2试纸变黑。
(7)氨气:无色有刺激性气味,使湿润的红色石蕊试纸变蓝,遇浓盐酸冒自烟。
(8)二氧化氮:红棕色气体通入水中溶液无色,生成无色气体,气体遇空气又变红棕色,水溶液显酸性。
(9)一氧化氮:无色无味在空气中立即变红棕色。
(10)二氧化碳:能使澄清石灰水变浑浊;能使燃着的木条熄灭。SO2气体也能使澄清的石灰水变混浊,N2等气体也能使燃着的木条熄灭。
(11)一氧化碳:可燃烧,火焰呈淡蓝色,燃烧后只生成CO2;能使灼热的CuO由黑色变成红色。
(12)甲烷:无色无味燃烧后生成CO2和H2O不能使KMnO4溶液、溴水褪色。
(13)乙烯:无色燃烧时火焰明亮有黑烟能使KMnO4溶液,溴水褪色。
(14)乙炔:无色无味,燃烧时火焰明亮有浓烟能使KMnO4溶液,溴水褪色。
(15)水:无水硫酸铜变蓝。
②几种重要有机物的检验
(1)苯:能与纯溴、铁屑反应,产生HBr白雾。能与浓硫酸、浓硝酸的混合物反应,生成黄色的苦杏仁气味的油状(密度大于1)难溶于水的硝基苯。
(2)乙醇:能够与灼热的螺旋状铜丝反应,使其表面上黑色CuO变为光亮的铜,并产生有刺激性气味的乙醛。乙醇与乙酸、浓硫酸混合物加热反应,将生成的气体通入饱和Na2CO3溶液,有透明油状、水果香味的乙酸乙酯液体浮在水面上。
(3)苯酚:能与浓溴水反应生成白色的三溴苯酚沉淀。能与FeCl3溶液反应,生成紫色溶液。
(4)乙醛:能发生银镜反应,或能与新制的蓝色Cu(OH)2加热反应,生成红色的 Cu2O沉淀。
(5)其它物质检验
能发生银镜反应的:醛、甲酸、甲酸某酯、甲酸盐、葡萄糖、麦牙糖;
能与溴水反应而使之褪色的:不饱和烃(烯、苯乙烯等)、不饱和烃的衍生物,苯酚(生成白色沉淀),裂化汽油、天然橡胶等;
能使酸性KMnO~溶液褪色的:不饱和烃,苯的同系物,不饱和烃的衍生物,含醛基的有机物等;
能与Na等活泼金属反应生成H2的:含羟基、羧基的液体有机物;
能使滴有酚酞的NaOH溶液褪色的:羧基、酚羟基。
3、物质鉴别:
物质的鉴别就是用物理或化学方法把几种物质区分开,其原则是:用最简单的方法,最少的试剂和最明显的现象进行鉴别,以达到简便、快速的最佳效果。
(1)不用任何试剂鉴别多种物质:
不用其他试剂来鉴别一组物质(可用水、加热等),一般情况从两个方面考虑:首先利用某些物质的特殊性质(如颜色、气味、溶解性等)鉴别出来,然后再用该试剂去鉴别其他物质;其次采用一种试剂与其他物质相互反应的现象不同,进行综合分析鉴别。
①特征现象法:先依据外观特征鉴别出其中一种或几种。再借用它们去鉴别其它物质。
例如:有五瓶溶液它们分别是KCl、Ba(NO3)2、Na2CO3、Na2SO4、FeCl3溶液,不用其它试剂或试纸,确定那瓶装的是哪种溶液。
思路:先观察出FeCl3,以FeCl3鉴别出Na2CO3,再用Na2CO3鉴别出Ba(NO3)2,再用Ba(NO3)2鉴别出Na2SO4和KCl。
②焰色反应或加热法:如果几种物质无明显外观特征,可考虑利用加热分解或焰色反应来区别。
例如:有四瓶失去标签的药品NaCl、K2SO4、NH4HCO3、NaHCO3,不用其它任何试剂如何将它们区别出来。
思路:先加热鉴别出NH4HCO3、NaHCO3,再用焰色反应鉴别NaCl、K2SO4。
③相互反应法:若待检物质较多且无明显特征,可以将这组待鉴物质依次编号,然后把它们两两混合,将产生现象列表进行推断一对号。
例如,A、B、C、D、E、F六瓶未知液,它们是MgSO4、BaCl2、(NH4)2CO3、AgNO3、HBr、NaOH。可用此方法鉴别。
④若待鉴物为两种时,且因试剂的加入顺序(量)不同而现象不同,可相互滴加。例如,NaOH和AlCl3的鉴别。
(2)限用一种试剂鉴别物质:
所选试剂与被鉴别物质分别作用时,现象必须分别不同才行。用一种试剂来鉴别多种物质时,所选用的试剂必须能和被鉴别的物质大多数能发生反应,而且能产生不同的实验现象。常用的鉴别试剂有FeCl3溶液、NaOH溶液、Na2CO3溶液、稀H2SO4、Cu(OH)2悬浊液等。
①当被鉴物中的阳离子相同阴离子不同时,可加入能与这些阴离子反应产生不同现象的阳离子。
例如:NaBr、Na2S、Na2SO3、Na2CO3、Na2SO4等溶液的鉴别,应选浓H2SO4为好。如鉴别Na2S、Na2SO3、Na2CO3、Na2S2O3、NaCl、NaAlO2六种溶液,加入盐酸或稀硫酸即可。
②当被鉴物阴离子相同,阳离子不同时,可选用强碱做鉴别试剂。
例如:鉴别某溶液中含有的NH4+、Mg2+、Al3+、Fe3+、Fe2+等离子用NaOH溶液即可。
③当被鉴物中存在强酸弱碱盐或强碱弱酸盐时,则可选用与其发生双水解,并能产生沉淀和气体的盐做试剂。例如CaCl2、H2SO4、Al2(SO4)、Na2SO4四种溶液,选用Na2CO3试剂就能将它们一一鉴别出来。
④当被鉴物中含有醛基、羟基、羧基、多羟基时,可考虑使用新制的Cu(OH)2来鉴别。
⑤若几种物质在水中的溶解性、密度或溶解时热效应不同,可选用水作鉴别试剂。例如:苯、乙酸、四氯化碳,可用水鉴别。
(3)任选试剂鉴别多种物质
此类题目不限所加试剂的种类,可用多种解法,题目考查的形式往往是从众多的鉴别方案中判断最佳方案。其要求是操作步骤简单,试剂选用最少,现象最明显。答题要领如下:
①选取的试剂和待鉴的各物质反应现象要专一,并且一目了然。
②不许原瓶操作,若原瓶操作,试剂将全部被污染。因此,操作中要“各取少许”。
③不能指名道姓。因为在加入某试剂前,该物质是未知的,一般简答的顺序是:取少量待鉴物![]() 溶解(指固体)
溶解(指固体)![]() 加入某试剂
加入某试剂![]() 描述现象
描述现象![]() 得出结论。
得出结论。
四、物质的制备
1、气体制备
气体的实验室制法是中学化学中的一个很重要的知识点,也是高考的一个重要考点.
(1)制备反应的选择:
一种气体可以由多种反应制得,但只有部分反应适合实验室制备.这些反应一般应符合以下几个条件:①反应物容易获得;②反应条件易达到;③反应容易控制;④生成的气体易分离。
(2)制取装置的选择:
气体的制取装置主要由反应物的状态和制备反应发生的条件所决定,实验室中常见的气体制取装置有3套,如下图所示:
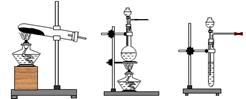
利用固体加热制取气体,适用装置I,例如制取O2、NH3、CH4等。利用有液体参加的不加热反应制取气体,可用装置Ⅱ(多数气体也可使启普发生器) 利用有液体参加的加热反应制取气体,宜用装置Ⅲ,例如制取Cl2、HCl、S02等。对于同种气体,若选用不同的制备反应,制取装置则可能不同,例如用浓氨水加热制NH3,应该用装置Ⅲ。
(3)制取气体的净化和干燥:
从制取装置中排出的气体常带有酸雾、水蒸汽及其他杂质。若要得到纯净、干燥的气体,就应对其净化和干燥.所制气体的净化应根据气体和所含杂质的性质及实验要求而进行。净化时选用的试剂应不与所制气体发生反应,但可与杂质充分反应,且不产生新的难分离杂质。不同方法制得的气体所含杂质可能不同,应根据具体情况选用不同的净化方法。
所制气体干燥时,应根据气体的性质选用对该气体不溶解,也不反应的干燥剂.一般酸性(碱性)气体不能用碱性(酸性)干燥剂干燥,还原性(氧化性)气体不能用氧化性(还原性)干燥剂干燥。例如,浓硫酸不能用来干燥H2S、HBr。等有一定还原性的气体。在对所制气体净化或干燥时,若选用的是液体试剂,应装在洗气瓶中使用;若选用的是固体试剂,应装入干燥管或U型管内使用,一般先净化后干燥。
(4)所制气体的收集方法:
实验室常用的气体收集方法有排空气法和排水法两种.
用排空气法收集的气体,应不与空气直接反应,且密度与空气的密度相差较大.排空气法可分为向上排空气法和向下排空气法,对于O2 、Cl2、CO2等密度大于空气的气体,用向上排空气法收集;对H2、NH3、CH4等密度小于空气的气体,用向下排空气法收集。但对CO、N2、NO等气体,因密度与空气接近而很难与空气分离(其中NO与氧气反应),一般不用排空气法收集。
用排水法只能收集难溶于水的气体,例如H2、N2、CH4等;而C12、NH3、NO2等可溶于水的气体不能用排水法收集.对于不能用排水法收集的气体,亦可考虑用排其它液体的方法收集.例如可用排饱和食盐水法收集C12。
(5)制备气体的基本步骤:
实验室制备气体一般按以下步骤进行:①连接仪器,②检查气密性,③装药品,④发生反应,⑤净化和干燥所制气体,⑥收集气体,⑦停止反应,⑧拆洗仪器。
2、几种重要物质的制备
①氢氧化铝;②氢氧化亚铁;③银铵溶液;④氢氧化铁胶体;⑤漂白粉;⑥溴苯;⑦乙酸乙酯;⑧几种重要物质的工业制法:硫酸、硝酸、合成氨、侯氏制碱法。
3、制备实验中涉及的几个重要问题
(1)防倒吸问题;(2)气密性检查;(3)水浴加热;(4)冷凝回流;(5)平衡气压;(6)尾气处理及防止热的产物变质;(7)加入液体顺序;(8)洗气(反应物和生成物)。
【教后记】
相关热词搜索:
上一篇:第十三单元 化学实验(3)
下一篇:第十三单元 化学实验(5)
