第十三单元 化学实验(3)
2015-12-01 08:32:58 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第十三单元 化学实验(3)
|
|
|
授课人:董 啸 |
|
|
①了解一般事故处理方法,能对常见物质进行检验、分离和提纯。
|
|
|
教学目标: |
②了解实验室常用仪器的主要用途和用法,能根据要求配制溶液。
|
|
|
|
③掌握化学实验的基本操作,掌握常见气体的实验室制法。 |
|
|
教学重点: |
物质的制备、检验、分离提纯 |
|
|
教学难点: |
设计、评价或改进实验方案 |
|
|
教学方法: |
分析比较法 |
|
|
教学过程: |
第三课时 |
|
基础知识精析
4、安全知识
实验安全是进行综合实验和实验设计所必须考虑的要素之一,也是顺利进行实验的前提保障。应掌握如下安全知识:
(1)常用危险化学药品的标志


(2)实验安全主要包括下列几个方面:
防漏气——实验前检查装置的气密性。
防爆炸——检验气体的纯度,有可燃性气体的实验,应将装置系统中的空气排净后再进行点燃和加热的操作。例如用H2、CO等气体还原金属氧化物的操作中,不能先加热金属氧化物,后通气,应当先通入气体,将装置内的空气排干净后,检查气体是否纯净(验纯),待气体纯净后,再点燃酒精灯加热金属氧化物。
防倒吸——溶解度很大的气体吸收要加防倒吸装置,对有加热要求的综合实验,在与液体接触的部位前部最好设置“安全瓶”等装置以防止倒吸,实验结束时要注意酒精灯熄灭及导管的处理顺序。
防污染——有毒尾气要通过吸收、收集、点燃等措施处理,防止中毒和污染环境。制取有毒气体(如Cl2、CO、SO2、H2S、NO2、NO等)时,应在通风橱中进行。
防伤害——使用和加工玻璃仪器要防划伤,加热、浓硫酸稀释等液体混合操作要防飞溅和灼烫伤。
防暴沸:加热液体混合物时要加沸石;
(3)实验安全装置
①防倒吸装置
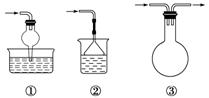
②防堵塞安全装置
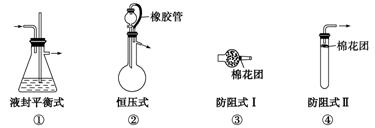
③防污染安全装置(见下图a、b、c)

说明:实验室制取Cl2时,尾气的处理可采用b装置。制取CO时,尾气处理可采用a、c装置。制取H2时,是否需尾气处理?需要。若需要可采取a、c装置。
(4)安全常识
①酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。钠、磷等失火宜用沙土扑盖。
②苯酚灼伤,先用乙醇洗涤,再用水冲洗。玻璃割伤等其他“机械类”创伤,应先除去伤口的玻璃等,再用双氧水擦洗消毒,尔后敷药包扎。烫伤宜找医生处理。
③浓酸撒在实验台上,先用Na2CO3 (或NaHCO3)中和,后用水冲擦干净;沾在皮肤上,宜先用干抹布拭去,再用水冲净;溅在眼中应先用稀NaHC03淋洗,然后请医生处理。浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净;沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液;溅在眼中,用水洗净后再用硼酸溶液淋洗。液溴滴到手上,要立即擦去,再用酒精或苯擦洗。
④使用、制备有毒气体时,宜在通风橱或密闭系统中进行,外加尾气吸收处理装置。不可尝药品味道。误食重金属盐应立即服生蛋白或生牛奶。汞洒落后,应立即撒上硫粉,并打开墙下部的排气扇。
⑤净化、吸收气体及熄灭酒精灯时要防液体倒吸。进行某些易燃易爆实验时要防爆炸(如H:还原CuO应先通H2,气体点燃先验纯等)。防氧化(如H2还原CuO后要“先灭灯再停氢”,白磷切割宜在水中等)。防吸水(如实验、取用、制取易吸水、潮解、水解物质宜采取必要措施,以保证达到实验目的)。
⑥冷凝回流,有些反应中,为减少易挥发液体反应物的损耗和充分利用原料,需在反应装置上加装冷凝回流装置(如长玻璃管、竖装的干燥管及冷凝管等)。易挥发液体产物(导出时为蒸气)的及时冷却。
⑦仪器拆卸的科学性与安全性(也从防污染、防氧化、防倒吸、防爆炸、防泄漏等角度考虑)。
⑧其他(如实验操作顺序、试剂加入顺序、使用顺序等) 。
(5)实验室一般伤害事故的处理方法
做化学实验时会偶发一些伤害事故,要进行必要的急救处理,使伤害降低到最小的程度,切不可听其自然。下面介绍一些常见伤害事故的处理方法:
①割伤急救:用消毒棉棍或纱布把伤口清理干净,小心取出伤口中的玻璃或固体物,然后将红药水涂在伤口的创面上。若伤口比较严重,出血较多时,可在伤口上部扎上止血带,用消毒纱布盖住伤口,立即送医院治疗。
②烫伤和烧伤的急救:轻度的烫伤或烧伤,可用药棉浸90~95%的酒精轻涂伤处,也可用3-5%高锰酸钾溶液擦伤处至皮肤变为棕色,然后涂上獾油或烫伤药膏。较严重的烫伤或烧伤,不要弄破水泡,以防感染。要用消毒纱布轻轻包扎伤处立即送医院治疗。
③化学灼伤的急救:一旦发生化学灼伤事故,都应于最短时间进行冲洗。冲洗时必须立足于现场条件,不必强求用消毒液和药水,凉开水、自来水都可应急。
总之,化学实验室一般伤害事故必须在现场进行急救和处理,切忌末经任何处理就送医院。
![]()
1.(2010·安徽理综,8)下列实验操作或装置符合实验要求的是( )

答案 A
解析 本题考查实验基本操作知识,意在考查考生对仪器选择和实验细节的掌握程度。B项容量瓶定容时,直到容量瓶中液面接近刻度线1~2 cm处时,再改用胶头滴管滴加;C项阳极材料铜是活泼电极,阳极铜放电,不符合实验要求;D项高温煅烧石灰石时,不能用酒精灯加热,应用酒精喷灯且灼烧过程中会产生CO2气体,坩埚不能加盖。
2.(2009·安徽理综,9)下列选用的相关仪器符合实验要求的是( )
|
A |
B |
C |
D |
|
存放浓硝酸 |
分离水和乙酸乙酯 |
准确量取9.50 mL水 |
实验室制取乙烯 |
|
|
|
|
|
答案 B
解析 本题主要考查实验基本操作以及实验仪器的使用,意在考查考生的实验操作能力。浓硝酸具有强氧化性,不能用橡胶塞,一般用玻璃塞,A选项错误;水和乙酸乙酯互不相溶,可以用分液漏斗分离,B选项正确;量筒量取液体只能精确到0.1 mL,C选项错误;实验室制取乙烯需要的温度为170℃,该温度计的量程不足,D选项错误。
3.(2010·重庆理综,7)下列实验装置(固定装置略去)和操作正确的是( )
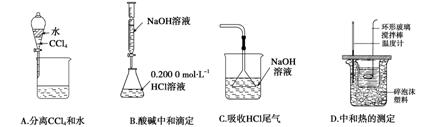
答案 A
解析 本题考查学生基本实验设计和化学常见仪器的识别能力,旨在通过本题考查学生对化学实验基本操作的理解和装置的正确应用。氢氧化钠溶液应该用碱式滴定管盛装,B错;HCl在NaOH溶液中极易溶解,容易造成溶液倒吸,漏斗不应该没入溶液中,C错;中和热的测定实验中,温度计应该插入反应液中,D错。
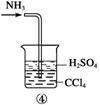
4.(2009·山东理综,30)若某实验过程中有氨气逸出,应选用下列___装置回收(填代号)。

答案 b
解析 氨气极易溶于水,要注意防倒吸,a装置广口瓶内的进气管长,容易倒吸,b装置中的倒置漏斗,可以防倒吸。
二、物质的分离和提纯
(1)物质分离和提纯的区别
物质的分离是得到混合物中各种纯净物,要保持原来的化学成分和物理状态;物质的提纯是净化混合物中的主体物质,不必考虑提纯后杂质的化学成分和物理状态。
(2)分离提纯的物理方法
①过滤:将不溶性固体从液体中分离出来的一种方法叫做过滤。
适用范围:不溶性固体和液体的分离。
仪器和用品有:铁架台(带铁圈)、烧杯、漏斗、玻璃棒、滤纸,操作中要注意一贴,二低,三靠原则。
一贴:滤纸紧贴漏斗内壁、中间无气泡.
二低:滤纸边缘略低于漏斗口;漏斗里液面略低于滤纸边缘.
三靠:倾倒液体的烧杯口紧靠玻璃棒;玻璃棒末端轻轻靠在三层滤纸处;漏斗下端管口紧靠烧杯内壁.必要时要洗涤沉淀物(在过滤器中进行),定量实验的过滤要“无损失”。
②蒸发:通过加热使溶液中的溶剂变成蒸气,溶质以晶体的形式析出,从而将溶质从溶液中分离出来的操作方法叫做蒸发。
适用范围:可溶性固体和溶剂的分离。
操作要求:玻璃棒要不停的搅拌,防止局部沸腾;出现较多固体时停止加热。
所用仪器:铁架台(带铁圈)、酒精灯、蒸发皿、玻璃棒;操作时要注意蒸发皿内盛液体不能太多,(不超过其容积的2/3),用玻璃棒不断搅拌,出现较多固体时停止加热,用余热蒸干。蒸发适用于分离溶于溶剂中的固体溶质。
③蒸馏:蒸馏是分离沸点不同的液体混合物的方法。
原理:利用液体混合物中各组分的沸点不同,用加热的方法,使沸点不同的物质先后从混合物中分离出来,从而除去液体混合物中的杂质(易挥发、难挥发或不挥发)。
适用范围:液态有机物中含少量相互混溶的液态杂质,且该有机物热稳定性较强,与杂质的沸点相差较大(相差30℃以上)。
所用仪器:铁架台(带铁圈、铁夹),酒精灯、石棉网、蒸馏烧瓶、温度计、冷凝管、接受器、锥形瓶。操作时要注意温度计水银球位置,冷凝水流向,加沸石。
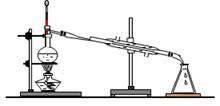
说明:冷凝管分为直型冷凝管和球型冷凝管两种,一般直型冷凝管用于分馏,球型冷凝管用于冷凝回流。
④重结晶:
将晶体加热溶于溶剂过滤除去不溶性杂质后,降温晶体又重新从溶液中结晶析出,然后通过过滤除去易溶性杂质的过程,叫做重结晶。
原理:重结晶提纯法的原理是利用混合物各组分在同一溶剂中的溶解度的差异,而使它们相互分离。
利用溶剂对被提纯物质及杂质的溶解度不同,可以使被提纯物质从过饱和溶液中析出。而让杂质全部或大部分仍留在溶液中,从而达到提纯目的。(若在溶剂中的溶解度极小,则配成饱和溶液后被过滤除去)
试剂要求:
①杂质在溶剂中的溶解度很小或者很大,易于除去;
②被提纯的有机物在溶剂中的溶解度,受温度的影响较大,冷却后容易结晶。试剂与被提纯的化合物不起化学反应。
重结晶提纯法的操作步骤:
①将粗产品溶于热溶剂;②趁热过滤,除去杂质;③冷却滤液,析出结晶;④过滤,分出结晶;⑤洗涤结晶,除去母液;⑥干燥结晶。
适用范围:重结晶提纯物质的方法,只适用于溶解度受温度影响很大的且随温度上升而增大的化合物。
⑤萃取:利用溶剂将一种物质从混合物中提取出来的操作,叫做萃取。
原理:萃取是利用溶质在两种互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从另一溶剂里提取出来的方法,分液是利用互不相溶的液体密度不同,用分液漏斗将它们一一分离出来。
所用仪器有:烧杯、漏斗架、分液漏斗、操作时注意上层液体从上口倒出,下层液体从下口流出。
萃取剂的要求:
a、溶质在萃取剂里的溶解度大于在原溶剂中的溶解度;
b、萃取剂与溶质和溶剂不反应;
c、萃取剂与溶剂不相互溶解。
萃取用的主要仪器:分液漏斗
萃取的操作方法:加液、振荡、静置、分液
【思考】分液漏斗在使用前必须检查是否漏液,如何检查是否漏液?
答案:关闭活塞,向分液漏斗中加入一定量的水倒置,观察是否漏水,若不漏水再将活塞旋转180°,然后倒置观察是否漏水。
⑥升华:分离固体混合物中某组分受热时易升华,如KI和I2所用仪器:酒精灯、烧杯、圆底烧瓶,铁架台带铁圈、石棉网。
【归纳与总结】依据物质的物理性质选择恰当分离(提纯)方法
(1)“固+固”混合物的分离(提纯)

(2)“固+液”混合物的分离(提纯)

(3)“液+液”混合物的分离(提纯)

【学以致用】分离、提纯原理和方法
1.下列分离物质的方法中,利用了物质的沸点的是 ( )
A.蒸馏 B.萃取 C.重结晶 D.蒸发
答案 A
解析 萃取、重结晶是利用物质溶解度的不同而分离,蒸发是通过加热将溶剂蒸发掉;蒸馏则是利用物质沸点不同将物质进行分离。
2.物质的分离、提纯是中学化学的重要操作,请应用物质分离、提纯知识,分离下列
各组混合物。
|
|
混合物 |
分离方法 |
操作过程 |
|
1 |
从草木灰中提取可溶性物质 |
|
|
|
2 |
KNO3和NaCl混合物 |
|
|
|
3 |
乙酸乙酯和乙酸混合物 |
|
|
|
4 |
由乙醇溶液制无水乙醇 |
|
|
3.以下实验装置一般不用于分离物质的是 ( )
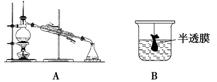

答案 D
解析 A项为蒸馏装置,用于互溶而沸点不同的液体混合物的分离;B项为渗析操作,用于胶体的净化;C项为过滤操作,用于固体和液体的分离;D项为配制一定物质的量浓度的溶液中的移液操作,不属于分离物质的操作。
4.下列实验装置图所示的实验操作,不能达到相应的实验目的的是 ( )
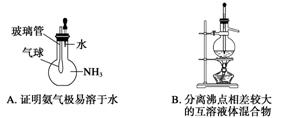
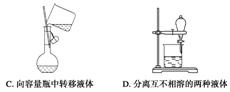
答案 B
解析 B选项中温度计的水银球位置应与蒸馏烧瓶的支管口对齐。
5.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:

(1)实验室焙烧海带,需要下列仪器中的________(填序号)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________,③__________。
(3)提取碘的过程中,可选择的有机试剂是 ( )
A.甲苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、甘油
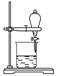 (4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有__________、__________。
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有__________、__________。
(5)小组用CCl4萃取碘水中的碘,在右图的分液漏斗中,下层液体呈______色;他们打开分液漏斗活塞,却未见液体流下,原因可能是_______。
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下
面实验装置图中的错误之处:
①_____________________________________________________________________;
②_____________________________________________________________________;
③_____________________________________________________________________。
(7)进行上述蒸馏操作时,使用水浴加热的原因是____________________________,
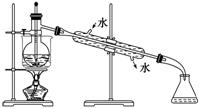
最后晶态碘在________里聚集。
答案 (1)cdef (2)①过滤 ③萃取 (3)B (4)分液漏斗 普通漏斗 (5)紫红 分液漏斗上口活塞小孔未与空气相通 (6)①缺石棉网 ②温度计插到了液体中 ③冷凝管进出水的方向颠倒 (7)使蒸馏烧瓶受热均匀,控制加热温度不至过高 蒸馏烧瓶
(3)分离提纯的化学方法
①原则:能转化则转化,不能转化则除去。
②方法:分析杂质与原物质间的性质差异,寻找分离的最佳方案。
③要求:操作简单,分离彻底,不引入新杂质,尽量不损耗原物质。
④目标:不增(不增加新杂质)、不减(不减少被提纯物质)、易分离(被提纯物与杂质易分离)、易复原(被提纯物易复原)、最佳(最好在除去杂质的同时,能够增加被提纯物质的量)。
【注意】:除杂试剂一般必须过量,过量的试剂必须除尽。
⑤常见的方法有:热分解法、氧化还原法、沉淀法、气体法、酸碱溶解法、水解法、洗气法。
(1)沉淀法:例如NaCl溶液里混有少量的MgCl2杂质,可加入过量的NaOH溶液,使Mg2+离子转化为Mg(OH)2沉淀(但引入新的杂质OH-),过滤除去Mg(OH)2,然后加入适量盐酸,调节pH为中性。
(2)气体法:例如Na2SO4溶液中混有少量Na2CO3,为了不引入新的杂质并增加SO42-,可加入适量的稀H2SO4,将CO32-转化为CO2气体而除去。
(3)氧化还原法:例如在 FeCl3溶液里含有少量 FeCl2杂质,可通入适量的Cl2气将FeCl2氧化为FeCl3。若在 FeCl2溶液里含有少量 FeCl3,可加入适量的铁粉而将其除去。
(4)正盐和与酸式盐相互转化法:例如在Na2CO3固体中含有少量NaHCO3杂质,可将固体加热,使NaHCO3分解生成Na2CO3,而除去杂质。若在NaHCO3溶液中混有少量Na2CO3杂质,可向溶液里通入足量CO2,使Na2CO3转化为NaHCO3。
【思考与交流】(1)食盐中可能含有硫酸盐、CaCl2、MgCl2,应如何除去?
(2)为什么食盐提纯时不用硝酸钡、碳酸钾、氢氧化钾溶液?
(3)虽然我们精选试剂,但是加入的试剂除去杂质的同时,可能会引入新的杂质,想想看应如何处理?
【结论】分别用足量的氯化钡、碳酸钠、氢氧化钠溶液除去硫酸盐、CaCl2、MgCl2;过量的氯化钡可以用碳酸钠除去,沉淀过滤后,溶液中过量的碳酸钠和氢氧化钠可以用盐酸除去。
【活学活用】1.除去下列常见物质中的杂质,完成表格:
|
序号 |
原物质 |
所含杂质 |
除杂质试剂 |
主要操作方法 |
|
① |
N2 |
O2 |
灼热的铜网 |
用固体转化气体 |
|
② |
CO |
CO2 |
NaOH溶液 |
洗气 |
|
③ |
CO2 |
CO |
灼热的CuO |
用固体转化气体 |
|
④ |
CO2 |
HCl |
饱和NaHCO3溶液 |
洗气 |
|
⑤ |
Cl2 |
HCl |
饱和食盐水 |
洗气 |
|
⑥ |
CO2 |
SO2 |
饱和NaHCO3溶液 |
洗气 |
|
⑦ |
碳粉 |
CuO |
稀酸(如稀盐酸) |
过滤 |
|
⑧ |
Fe2O3 |
Al2O3 |
NaOH溶液 |
过滤 |
|
⑨ |
NaHCO3溶液 |
Na2CO3 |
CO2 |
加酸转化 |
|
⑩ |
NaCl溶液 |
NaHCO3 |
HCl |
加酸转化 |
|
⑪ |
FeCl3溶液 |
FeCl2 |
Cl2 |
加氧化剂转化 |
|
⑫ |
FeCl2溶液 |
FeCl3 |
Fe |
加还原剂转化 |
|
⑬ |
I2晶体 |
NaCl |
无 |
加热升华 |
|
⑭ |
NaCl晶体 |
NH4Cl |
无 |
加热分解 |
|
⑮ |
乙烷 |
C2H4 |
溴的四氯化碳溶液 |
洗气 |
|
⑯ |
乙酸乙酯 |
乙酸 |
饱和Na2CO3溶液 |
分液 |
|
⑰ |
乙醇 |
水(少量) |
新制CaO |
蒸馏 |
2.下列是制备CuO的流程图:
工业CuSO4 CuSO4溶液CuSO4·5H2O―→……―→CuO
(1)步骤Ⅰ的目的是除去不溶性杂质。操作是________________________________。
(2)步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是__________________。
(3)步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是_________________________,过滤,水浴加热烘干。水浴加热的特点是___________________________________。
答案 (1)溶解,过滤
(2)使Fe3+可全部转化为Fe(OH)3沉淀,而Cu2+不会转化为Cu(OH)2沉淀
(3)将CuSO4溶液加热蒸发至有大量晶体出现时,停止加热 受热均匀,温度易于控制在100 ℃以下
解析 (1)不溶性杂质由于不溶于水,采用过滤的方法除去。(2)步骤Ⅱ操作:向含有CuSO4、FeSO4的溶液中滴加H2O2,发生反应:2Fe2++H2O2+2H+===2Fe3++2H2O,此时溶液的pH<3.5,而pH=3.5时,Fe(OH)3沉淀易形成,故此时要加入Cu2(OH)2CO3粉末,以中和H+,控制pH=3.5,同时加热煮沸,使Fe3+水解趋于完全,生成Fe(OH)3沉淀,同时抑制Cu2+的水解,过滤除去Fe(OH)3沉淀,再加稀硫酸酸化得到CuSO4溶液。 (3)通过蒸发溶剂、冷却结晶的方法析出硫酸铜晶体,加热烘干时温度不能超过100 ℃,且需温度恒定,以防温度过高使硫酸铜分解,因此采用水浴加热。剂应能够把前面所加入的无关物质或离子除去。
3.(2012·山东理综,30)实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备
MgAl2O4,主要流程如下:

(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)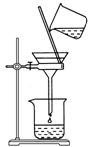 如右图所示,过滤操作中的一处错误是________。
如右图所示,过滤操作中的一处错误是________。
(3)判断流程中沉淀是否洗净所用的试剂是__________。高温焙烧
时,用于盛放固体的仪器名称是________。
(4)无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用
下列装置制备。
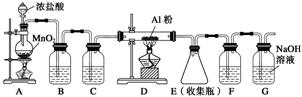
装置B中盛放饱和NaCl溶液,该装置的主要作用是________。F中试剂的作用是________。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为________。
答案 (1)B (2)漏斗下端尖嘴未紧贴烧杯内壁 (3)AgNO3溶液(或硝酸酸化的AgNO3溶液) 坩埚 (4)除去HCl气体 吸收水蒸气(或防止水蒸汽进入E) 碱石灰(或NaOH与CaO混合物)

1.判断正误,正确的划“√”,错误的划“×”
(1)![]() 用CCl4提取溴水中的Br2 (√)(2012·天津理综,4A)
用CCl4提取溴水中的Br2 (√)(2012·天津理综,4A)
解析 CCl4和水不互溶,分层,采取分液的方法分离。
(2) 除去乙醇中的苯酚 (×)(2012·天津理综,4B)
除去乙醇中的苯酚 (×)(2012·天津理综,4B)
解析 乙醇和苯酚混溶,不能采取过滤的方法。
(3)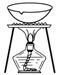 从KI和I2的固体混合物中回收I2 (×)(2012·天津理综,4C)
从KI和I2的固体混合物中回收I2 (×)(2012·天津理综,4C)
解析 该装置无法回收气态碘且蒸发皿加热不需垫石棉网。
(4)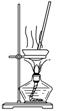 用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 (×)(2012·江苏,6B)
用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 (×)(2012·江苏,6B)
解析 NH4Cl加热易分解。
(5)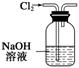 用图所示装置除去Cl2中含有的少量HCl (×)(2012·江苏,6A)
用图所示装置除去Cl2中含有的少量HCl (×)(2012·江苏,6A)
解析 除去Cl2中的HCl应用饱和食盐水。
(6)将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 (×)
(2011·广东理综,10C)
解析 过滤时,应使用玻璃棒引流。
(7)将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl (×)(2012·广东理综,9D)
解析:混有HCl的Cl2通过饱和NaHCO3溶液产生CO2,形成杂质且Cl2也能被溶液吸收。
(8)受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 (×)(2012·浙江理综,8D)
解析 受强酸腐蚀致伤时,应先用大量水冲洗,再用3%~5%碳酸氢钠溶液处理。
(9)除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 (√)(2011·浙江理综,8D)
解析 SO2具有还原性,可被KMnO4溶液氧化而除去。
2.(2012·北京理综,8)下列试验中,所选装置不合理的是 ( )

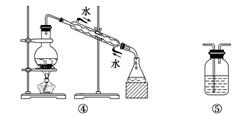
A.分离Na2CO3溶液和CH3COOC2H5,选④
B.用CCl4提取碘水中的碘,选③
C.用FeCl2溶液吸收Cl2选⑤
D.粗盐提纯,选①和②
答案 A
解析 解答本题主要从物质的性质、实验原理、仪器的选择是否正确等角度去分析。CH3COOC2H5与Na2CO3溶液互不相溶,故应选择分液法将其分离,因此选③,A错;用CCl4提取碘水中的碘,应选择分液漏斗萃取分液,B正确;将Cl2通过盛有FeCl2溶液的洗气瓶,将Cl2吸收,C正确;粗盐提纯应先将粗盐溶于蒸馏水中,然后过滤除掉泥沙等不溶物,再蒸发、浓缩最后得到NaCl晶体,D正确。
3.(2009·广东理基,24)下列除去杂质的方法正确的是 ( )
A.除去CO2中混有的CO:用澄清石灰水洗气
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
答案 C
解析 CO2可以被澄清石灰水吸收,而CO不可以,故A项错;盐酸可以将BaCO3反应除去,而不能溶解BaSO4,故B项错;C项,2FeCl3+Fe===3FeCl2,过量的铁过滤即可除去,正确;Cu和CuO均可以被HNO3溶解,故D项错。
【教后记】
相关热词搜索:
上一篇:第十三单元 化学实验(2)
下一篇:第十三单元 化学实验(4)



