第一节 金属的化学性(1)
2015-10-19 15:08:19 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第一节 金属的化学性(1)
|
三维目标: |
|
授课人:董 啸 |
|
知识与技能: |
①使学生认识了解钠的物理性质,掌握钠的化学性质。 |
|
|
|
②掌握镁和铝、铁的化学性质。 |
|
|
|
③了解钠、镁、铝、铁的存在及用途。 |
|
|
过程与方法: |
①培养学生根据实验现象探究、分析、推理和判断的能力。 |
|
|
|
②发挥学生的主体作用,做好探究性实验。 |
|
|
情感、态度 |
①通过动手实验,体验化学的奥秘,激发学生学习兴趣。 |
|
|
与价值观 |
②培养学生勇于探索的科学精神和严格求实的科学态度。 |
|
|
教学重点: |
钠和铝的化学性质 |
|
|
教学难点: |
铝和水反应 |
|
|
教学方法: |
实验探究法 |
|
|
教学准备: |
多媒体课件 |
|
|
教学过程: |
第1课时 |
|
【复习】初中所学有关铁的性质。
【引言】金属在人类社会的发展中发挥着重要作用,影响着社会发展的进程,所以我们有必要认真了解金属,掌握它们的性质,使其更好的为我们服务。在实验室中,有哪些物品是由金属制成的,在家里呢?
[学生回答] 水龙头、铁凳、铁窗筐,铁架台……
[过渡]大多数金属元素在自然界中都是以化合态形式存在,说明大多数金属的化学性质比较活泼。今天我们再来进一步学习有关金属的化学性质。
【板书】 第三章 金属及其化合物
【过渡】在初中化学中我们学习过金属,对其有初步的了解,那么它的物理性质如何。
〖引导分析〗学生回忆金属的物理性质。
【板书】金属的物理性质:金属都具有金属光泽,有延展性,不透明,易导电导热等性能。不同金属有不同的硬度、熔点、密度等。
【过渡】在人类已发现的一百多种元素中,大约有4/5是金属元素(引导学生看元素周期表),多数金属的化学性质都比较活泼。因此,绝大多数金属元素在自然界中总是以化合态存在。但亦有少数以游离态存在的金属(如,Ag、Cu、Au、Pt)。今天我们来重点探究金属的化学性质。
【板书】 第一节 金属的化学性质
【思考与交流】金属的原子结构有什么特点?从氧化还原的角度推测金属具有什么性质?金属有哪些共同的化学性质?
①举例说明金属能发生哪些化学反应?
[归纳]金属与氧气反应、金属与酸反应、金属与盐反应。
②课本图3-2是一些化学反应的照片,请分析这些反应,并写出化学方程式。
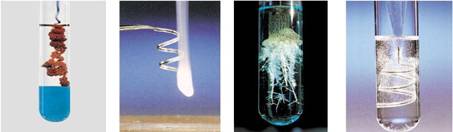
铝与硫酸铜溶液反应
③画出钠、镁、铝的原子结构示意图,分析它们的原子结构有什么特点,与金属的核心性质有什么联系?
【过渡】下面我们重点来从金属的几个具体反应类型来认识金属的化学性质。
〖分析引导〗金属一般容易失去电子,而非金属一般容易得到电子,所以我们首先探究金属与非金属的反应。
【板书】一、金属与非金属的反应
〖引导学生阅读〗p47第一自然段,分析金属与氧气的反应。
【结论】活泼金属可以与氧气反应,不活泼金属即使高温也不与氧气反应。
【板书】1、钠与非金属反应
【演示实验】请学生仔细观察实验3—1,并观察现象。
【实验现象】钠可以被刀切开,看到银白色具有金属光泽。很快金属光泽变暗。
【实验探究】①以上实验说明了金属钠具有怎样的物理性质?②刚才切开钠时看到银白色,但很快就失去光泽,为什么?
【板书】①银白色、有金属光泽,质软。②钠与氧气很容易反应。
【小资料】钠的物理性质:银白色、有金属光泽的固体,热、电的良导体,质软,密度小,熔点低。
【问题与思考】请同学们从原子结构示意图进行分析、探究,推导出钠的化学性质。(复习:质子数=核外电子数=核电荷数=原子序数)
【学生探究】钠的原子结构示意图、讨论其化学性质。
【板书】钠的原子结构示意图:
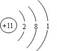
【探究结论】由于原子最外层只有一个电子,容易失去一个电子,表现还原性,所以钠的化学性质非常活泼。
【板书】(1)常温下钠与氧气反应:4Na + O2 == 2Na2O(白色固体)
(判断其是否为氧化还原反应,氧化剂、还原剂分别是哪一种物质)
【提出问题】金属钠放在空气中易被氧化,那么对金属钠进行加热反应又将如何?
(2)加热情况下钠与氧气反应
【实验探究】实验3-2
【实验现象】(让学生描述出反应的实验现象)钠先熔化成小球,然后燃烧,发出黄光,生成一种淡黄色固体过氧化钠(Na2O2)。
【板书】2Na + O2 Δ Na2O2 (淡黄色固体)
[设问] 生成物是氧化钠吗?
[学生回答]不是,生成物呈浅黄色,而氧化钠是白色固体。判断其是否为氧化还原反应,氧化剂、还原剂分别是哪一种物质。
(3)钠与氯气反应:2Na+Cl2![]() 2 NaCl
2 NaCl
(4)钠与硫反应:2Na+S==Na2S(钠还可以和硫单质反应,甚至发生爆炸,生成Na2S。)
2、其它金属与非金属反应
(1)与氧气反应
活泼金属在空气中易与氧气反应,表面生成一层氧化膜。有的氧化膜疏松不能保护内层金属,如铁锈;有的氧化膜致密可以保护内层金属,阻止继续被氧化。
【过渡】初中我们学习过铝在氧气中的燃烧(铝与氧气的反应: 4Al+3O2 点燃 2Al2O3),若铝在空气中加热,又有什么现象呢?铝箔在空气中很难点燃,为什么?
【探究实验】①镁带在空气中燃烧时,先要将表面打磨,这样容易点燃。
②用坩埚钳钳住一块铝片在酒精灯上加热至熔化,轻轻晃动。
[实验现象] 镁带在空气中燃烧;铝片在酒精灯上加热逐渐熔化,失去光泽,但不滴落。
[分析原因] 磨去氧化膜的铝片在空气中很快又形成一层新的氧化膜。铝的化学性质很活泼,容易与空气中的氧气反应形成致密氧化膜而稳定存在于空气中。
【探究结论】镁带可以在空气中燃烧,但是铝箔不可以燃烧,原因是铝箔外面有一层致密的氧化物保护膜,阻止了铝和氧气的接触。
【学生活动】请同学们写出镁、铝、铁分别与氧气反应的化学方程式。
【学生阅读】请学生自己阅读49页资料卡片的有关铝的氧化膜的有关内容。
【归纳总结】金属容易失去最外层电子,表现出较强的还原性,易与非金属发生氧化还原反应。
[设问]能否看出金属的活动性和金属与氧气反应的条件、剧烈程度有什么关系?
[小结]金属的活动性越强,与氧气反应就越易进行;金属活动性越弱,与氧气发生反应越难。
例如铁在空气中不能被点燃,俗语说“真金不怕火炼”就说明金在加热条件下不与氧气反应。
(2)与其它非金属反应
由于金属容易失去电子表现出还原性,所以金属还可以与氯气和硫等非金属单质反应。
〖试一试〗请同学们写出镁、铝、铁分别与氯气和硫反应的方程式。
【过渡】由于金属容易失去电子表现出还原性,酸有氧化性,所以它们可以相互反应。
【板书】二、金属与酸和水反应
1、金属与酸反应
初中化学我们已经学习了金属活动性顺序表中氢以前的金属可以和酸反应,生成盐和氢气。请同学们写出几个具体反应。
Fe+2HCl= FeCl2+H2 Zn+2HCl= ZnCl2+ H2
【说明】①金属活动性顺序表中氢以后的金属也可以和氧化性酸反应,但是生成物没有氢气。②金属与硝酸或浓硫酸发生反应的产物中没有氢气。
【过渡】人们常用金属器皿来盛水,也常用铁、铝或铜制的水壶来烧水,说明这几种金属与热水是不反应的。是不是所有的金属都不与水反应呢?
2、金属与水反应
(1)钠与水的反应
【演示实验】演示教材49页实验3-3,请同学们仔细观察实验现象。
【实验现象】①钠浮在水面;②钠熔化成闪亮的小球;③小球在水面四处游动,并发出嘶嘶声;④钠逐渐变小,最后完全消失;⑤滴有酚酞的水变红。
钠与水反应现象可以归纳为:浮、熔、游、响、红。
【实验探究】1.钠为什么会浮在水面上?
2.钠为什么会熔化成一个小球?
3.小球为什么会在水面上游动?
4.滴入酚酞后溶液为什么会变色?
5.保存钠的无色液体是否为水?
6.钠在实验室如何保存?
【板书】钠与水的反应: 2Na+2H2O=2NaOH+H2↑
问题:判断其是否为氧化还原反应,氧化剂、还原剂分别是哪一种物质?写出钠与水反应的离子方程式?
【思考与交流】分析上面各反应中,钠元素化合价的变化,能否从原子结构方面来说明?
【总结】钠在上述反应中,化合价均由0价变为+1价,这是由于钠原子的最外层只有一个电子之故,因此,钠在化学反应中易失电子,化学性质非常活泼,具有还原性,是一种强还原剂。
【自主探究】
1.钠元素在自然界中以什么形态存在?为什么?怎样保存金属钠?为什么要这样保存?
【钠的保存】密封保存、少量钠保存在煤油中。
【钠的存在】钠是一种化学性质活泼的金属,在自然界中以化合态存在。
2. 钠能否与硫酸铜溶液发生置换反应得到铜?写出反应的化学方程式。
3.钠着火以后能否用水来灭?试分析钠在空气中久置所发生的变化现象?
4、将钠投入到煤油和水的混合物中的现象是什么?
(2)其它金属与水反应
①钾、镁和铝与水反应:
【分析】钾活泼性比钠强,与水反应更剧烈。活泼性比钠弱的金属与水反应越来越难。请写出化学方程式。
②铁与水反应:3Fe+4H2O(g)=Fe3O4+4H2↑
[思考]铁不与冷水、热水反应,是否与水蒸气反应?
[科学探究]按图组装实验装置进行实验,记录实验现象,写化学反应方程式。
[实验现象] 铁丝保持红热,肥皂泡燃烧。
化学方程式:3Fe+4H2O(g)![]() Fe3O4+4H2↑
Fe3O4+4H2↑
【思考题】将金属钠分别投入下列物质的溶液中,有气体放出,且溶液质量减轻的是( )
A.HCl B.K2SO4 C.CuCl2 D.饱和NaOH溶液
〖答案〗C、D
【方法与技巧】
在有关金属与酸反应生成氢气的反应关系中:
一价金属:2R—H2 ; 二价金属: R—H2 ;三价金属: 2R—3H2
为了分析方便,可以统一将关系转化为:2R—nH2
例题:1.8g某金属与足量稀硫酸反应,产生2.24L(标况)氢气,该金属为:
A. Na B.Mg C.Al D.Fe
解析:2R——nH2
0.2/n 0.1
M=1.8g/0.2/n mol=9n
若n=1,M=9;若n=2,M=18;若n=3,M=27。
故,该金属为铝。
〖板书设计〗 第三章 金属及其化合物
第一节 金属的化学性质(第一课时)
一、金属与非金属的反应
1、钠与非金属反应:4Na + O2 = 2Na2O 2Na + O2=Na2O2
2、其它金属与氧气反应
二、金属与酸和水反应
〖教后记〗
上一篇:第一节 金属的化学性质(2)
下一篇:第二节 几种重要的金属化合物(1)
