第一节 无机非金属材料的主角—硅(1)
2015-10-19 15:11:40 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第一节 无机非金属材料的主角—硅(1)
|
三维目标: |
|
|
|
①了解硅元素在自然界中的存在形式及二氧化硅的性质; |
|
知识与技能: |
②了解硅酸的性质及制法,了解硅酸钠的性质; |
|
|
③知道硅、二氧化硅的在信息技术、材料等领域的应用。 |
|
过程与方法: |
①自主学习,培养学生的自学能力。 |
|
|
②通过硅与碳比较,培养学生归纳能力、比较能力。 |
|
情感、态度 |
①通过硅及其用途的学习使学生热爱自然,热爱化学。 |
|
与价值观 |
②培养学生学习元素化合物知识的正确方法。 |
|
教学重点: |
二氧化硅的主要化学性质 |
|
教学难点: |
二氧化硅晶体结构 |
|
教学方法: |
系生产和生活实际,激发学生的学习兴趣 |
|
教学准备: |
多媒体课件 |
|
教学过程: |
第一课时 |
【引言】在上一章我们已经学习了金属及其化合物的知识,我们知道,在已经发现的一百多种元素中,金属占了大约80%,除稀有气体外,非金属元素只有十多种,它们大都位于元素周期表的右上部。本章我们将要分别学习硅、氮、硫、氯这四种元素及其所形成的化合物的知识,这些元素的化合物的性质与人类社会有密切的关系。
第四章 非金属元素及其化合物
【过渡】这节课我们首先来学习一种非常重要的无机非金属材料—硅。
【板书】第一节 无机非金属材料的主角——硅
[图片展示]第一组:岩石、沙子、土壤;第二组:水晶、玛瑙、石英光导纤维;第三组:陶瓷、玻璃、水泥;第四组:U盘、硅太阳能电池、计算机芯片。
【过渡】通过以上关于硅的精美图片,我们不难发现,硅及其化合物在非金属材料和信息技术等领城,在建筑、通信、光电技术及航空航天等方面有广泛的应用,在社会发展历程中、国民经济中、信息化社会中扮演了重要的角色。
【问题】请简要阅读课文第一自然段后回答课文标题中“无机非金属材料的主角-硅”“主角”两个字在这里的涵义是什么?(学生回答:硅含量仅次于氧,硅的氧化物和硅酸盐构成地壳的主要部分。展示:硅在地壳中的含量。)
[讲述]硅在地壳中的含量为26.3%,硅的氧化物及硅酸盐构成了地壳中的大部分岩石、沙子和土壤,约占地壳质量90%以上。各种各样的硅酸盐和水、空气和阳光构成了人类及生物生存的根基。自古至今,在无机非金属材料中,硅一直扮演着主角的角色。
【板书】硅的存在:硅在地壳中的含量仅次于氧,硅的氧化物及硅酸盐约占地壳质量90%以上。
[设问]为什么硅的用途这么广泛呢?我们经常说结构决定性质,那么,硅的性质与它的结构有什么必然联系呢?请同学们利用原子结构进行探究。
【探究问题】
1、请画出碳和硅原子结构示意图。
2、碳元素和硅元素的原子结构有什么异同?原子最外层电子决定物质性质,推测硅单质的性质有哪些?
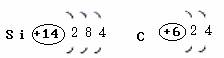
[探究结论]硅和碳元素一样,原子最外层均有四个电子。其原子即不容易失去电子又不容易得到电子,主要形成四价的化合物。二氧化硅、硅酸和硅酸盐是硅的最重要的化合物。
【过渡】虽然硅的原子既不易失电子,也不易得电子,但是它却很喜欢跟氧呆在一起,是一种亲氧元素。因此,它在自然界中总是与氧相互结合,主要以氧化物及硅酸盐的形式存在。下面我们就从最简单的硅的氧化物二氧化硅入手来学习硅。
[板书]一、二氧化硅(SiO2)
[引导]请同学们阅读教材P75。根据图片和文字回答, SiO2的存在形态? SiO2具有哪些用途?
[讲述]地球上天然二氧化硅成为硅石,约占地壳质量的20%,存在形态有结晶性和无定性两种。
[板书]1、存在形态:二氧化硅是硅元素的最重要的化合物,二氧化硅的存在形态有结晶形、无定形两大类,统称硅石。
(1)二氧化硅的晶体是石英,石英分为水晶和玛瑙。石英中无色透明的晶体是水晶;石英中具有彩色环带状或层状的称为玛瑙。
[图片展示]水晶、玛瑙、石英光导纤维、石英坩埚。
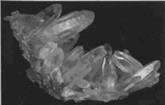


水晶 玛瑙 玛瑙饰品


石英坩埚 光导纤维晶体结构:请同学们课后阅读教材P75科学视野。
(2)二氧化硅晶体模型:
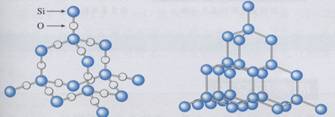
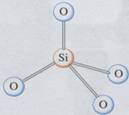
[分析]将晶体硅结构中的每一个“硅-硅”共价键打开,并在其间夹入一个氧原子,就形成了二氧化硅的晶体。这样,每个硅原子和四个氧原子以共价键结合,形成以该硅原子为中心的正四面体型结构,这种正四面体型结构向空间伸展,就形成了具有空间网状结构的原子晶体。由于每个氧原子同时和两个硅原子结合,所以二氧化硅晶体中,硅氧原子数之比为1:2,SiO2只表示一种比例关系,并不表示晶体中存在SiO2的小分子。
[讲述]石英可用来做石英钟、石英表,耐高温的石英玻璃;水晶可以用来制造电子工业中的重要部件、光学仪器、工艺品、眼镜片等,含有有色杂质的石英,还可用于制造精密仪器轴承,耐磨器皿和装饰品等。
2、用途:石英可用来做工艺品、光学仪器、光导纤维、建筑材料、耐高温耐磨仪器。
【思考与交流】根据二氧化硅的存在和用途分析,二氧化硅的物理性质是什么?二氧化硅是否稳定?二氧化硅性质与什么有关?
【结论】熔点高、硬度大,不溶于水的固体;性质稳定;结构稳定决定了性质稳定。
3、物理性质:熔点高、硬度大,不溶于水的固体。
【过渡】由以上分析可知,由于二氧化硅结构稳定,所以化学性质也比较稳定。性质稳定,并不是不和别的物质反应。
4、化学性质:
[讲述]二氧化硅是酸性氧化物,在一定条件下能与强碱、碱性氧化物反应。
(1)SiO2与CaO反应:
![]()
(2)SiO2与NaOH溶液反应:
SiO2+2NaOH=Na2SiO3+H2O
注意:该反应在常温下,缓慢反应。
[思考]实验室盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞,你知道为什么吗?
[结论]已知玻璃中含有SiO2,NaOH和SiO2常温下缓慢反应可以生成硅酸钠,而硅酸钠是一种粘合剂,能将瓶塞与试剂瓶粘在一起,所以实验室中盛放碱液的试剂瓶用橡皮塞而不用玻璃塞。
展示:瓶塞被粘住一个试剂瓶。要学生来打开,引发学生讨论。
(3)SiO2的特殊性:SiO2+4HF=SiF4↑+2H2O
注意:该反应在常温下,迅速反应。
[强调]酸性氧化物一般不与酸发生化学反应,而SiO2只能与氢氟酸反应,不能与其它酸反应,这是用氢氟酸雕刻玻璃的反应原理。
[思考]氢氟酸和NaOH溶液均可以在常温下和玻璃中的SiO2反应,为什么可用氢氟酸雕刻玻璃?而不用NaOH溶液?用什么容器来盛氢氟酸?
(4)SiO2与碳酸盐的反应(应用于玻璃生产)
![]()
![]()
【小结】SiO2化学稳定性好,常温下可以与强碱(如NaOH)等缓慢反应,属于酸性氧化物,可以与氢氟酸反应,不与其它酸反应。
[过渡]刚才我们提到二氧化硅不能溶于水得到相应的酸——硅酸。那么,硅酸是怎样的一种酸?它怎样制得呢?下面我们就来学习这个问题。
[板书]二、硅酸(H2SiO3)
1、硅酸的制取:
【思考】:硅酸(H2SiO3)能通过二氧化硅与水反应制得吗?为什么?
【结论】由于SiO2不溶于水,所以硅酸可以通过可溶性硅酸盐和酸反应制取。
[实验4—1]试管中加入3~5mL Na2SiO3饱和溶液,滴入2~3滴酚酞试液,再用胶头滴管逐滴滴入稀盐酸,边滴边震荡,至红色变浅并接近消失停止,记录现象。
|
现象 |
红色消失,有透明凝胶产生 |
|
结论 |
可以用Na2SiO3和HCl反应制取H2SiO3 |
|
化学方程式 |
Na2SiO3+2HCl=2NaCl+H2SiO3(胶体) |
2、物理性质:白色胶状物,不溶于水。
3、化学性质:弱酸,酸性比碳酸还弱,可以与强碱反应。受热干燥失水,形成硅胶干凝胶,做干燥剂。
Na2SiO3+H2O+CO2==H2SiO3↓+Na2CO3 H2SiO3+2NaOH=Na2SiO3+2H2O
4、用途:硅胶多孔,吸附水份能力强,常用作实验室和袋装食品、瓶装药品等的干燥剂,也可以用作催化剂的载体。
[课堂习题]
1、南方某一工厂工人经常得一奇怪的肺病(肺矽病),经查此病主要是由一种矿物粉尘在空气中含量过高而引起,粉尘得主要成分是( )
A.C B.CaCO3 C.SiO2 D. Si
2、下列有关二氧化硅的叙述中错误的是( )
A.SiO2是酸性氧化物,它对应的水化物是硅酸(H2SiO3)
B.硅酸可由SiO2直接制得
C.SiO2可与碱性氧化物或强碱反应
D.光导纤维的主要原料就是SiO2
3、下列溶液中可以盛放在玻璃瓶中,但不能用磨口玻璃塞的是( )
A.硅酸钠溶液 B.氢氟酸 C.氢氧化钠溶液 D.氯化钠溶液
〖板书设计〗 第一节 无机非金属材料的主角——硅
一、二氧化硅(SiO2)
1、存在形态:结晶形、无定形;
2、物理性质:熔点高、硬度大,不溶于水的固体。
3、化学性质:
(1)与CaO反应 (2)与NaOH溶液反应 (3)与氢氟酸反应
4、用途:可制造光导纤维、化学仪器、光学仪器、钟表、电子部件等。
二、硅酸
1、硅酸的制取 2、物理性质 3、化学性质
〖教后记〗
上一篇:第三节 用途广泛的金属材料
下一篇:第一节 无机非金属材料的主角—硅(2)
