第二节 化学计量在实验中的应用(2)
2015-10-14 21:42:45 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第二节 化学计量在实验中的应用(2)
|
三维目标: |
|
授课人:董 啸 |
|
知识与技能: |
①使学生认识摩尔是物质的量的基本单位。 |
|
|
|
②了解物质的量与微观粒子之间的关系。 |
|
|
|
③了解摩尔质量的概念。 |
|
|
过程与方法: |
通过学习使学生掌握科学探究的基本方法。 |
|
|
|
|
|
|
情感、态度 |
通过对摩尔概念的认识,使学生认识到探索的乐趣,激发学生 |
|
|
与价值观 |
探究科学的兴趣。 |
|
|
教学重点: |
物质的量及其单位 |
|
|
教学难点: |
物质的量及其单位 |
|
|
教学方法: |
分析比较法 |
|
|
教学准备: |
多媒体课件、实验用品 |
|
|
教学过程: |
第二课时 |
|
【复习】1、物质的量含义、单位、符号是什么?
①含义:表示构成物质的微观粒子多少的物理量。它表示一定数目粒子的集合体。符号:n ,单位:摩尔(mol)
2、阿伏加德罗常数含义符号及近似值?
0.012kg12C所含的碳原子数叫做阿伏加德罗常数。符号:NA,通常用近似值6.02×1023mol-1
[故事]古时侯,有一个聪明勇敢的小伙子想娶和他的心心相印的美丽的公主,可是国王不答应,故意出题刁难,他的其中一个问题是:1000kg小米是多少粒?同学们你们能不能帮帮他?
[思考、讨论、回答]
[追问]这些方法中,那种方法最科学?
[追问]谁能介绍几种生活中相似的例子?
【过渡】我们在进行科学实验或者化学计算中常常关心一定量的物质的质量是多少,下面让我们来做一个探究,了解其与物质的量的关系。
【探索与发现】我们知道,宏观物体是由许许多多微观粒子堆积在一起形成的,所以宏观物体的质量一定与物质的量有着特定的关系,请同学们一起来探索。
图1、 微观粒子与宏观可称量物质之间的联系
[投影练习]:计算1mol各物质的质量
|
物 质 |
H2O |
Al |
H2SO4 |
|
物质的量 |
1mol |
1mol |
1mol |
|
粒子数 |
6.02×1023 |
6.02×1023 |
6.02×1023 |
|
一个分子或 原子的质量 |
2.990×10-23g |
4.485×10-23g |
1.628×10-22g |
|
质 量 |
|
|
|
|
相对分子(或原子)质量 |
18 |
27 |
98 |
【探索发现】:1mol各物质的质量刚好和他们的相对分子质量或相对原子质量的数值相等。
【反问】这难道是巧合吗?应如何来看待这一问题?
〖方法指导〗数学归纳法和行动研究及资料搜集结合,寻找其中的奥秘。注意联系元素相对原子质量的定义和阿伏加德罗常数的含义。
【图片展示】:图2、 1mol物质的质量
[学生阅读]P12第3、4自然段
[学生归纳、回答] 1mol任何粒子或物质所含的微粒数目都是6.02×1023个。
①1mol任何原子的质量在数值上等于这种原子的相对原子质量。
②1mol任何分子的质量在数值上等于这种分子的相对分子质量。
③1mol任何离子的质量在数值上等于这种离子的式量。
【归纳】大量实验证明, 1mol任何粒子或物质的质量都以克为单位,在数值上与该粒子的相对原子质量或相对分子质量相等。
【过渡】由此我们可以看出,每一种物质每摩尔的质量数值都等于其相对质量,为了计算方便,引出一个新的物理量。
[板书]5、摩尔质量:
①定义:单位物质的量的物质所具有的质量叫做摩尔质量。
②摩尔质量的符号为:M;
③单位: (克/摩)g/mol
④规律:粒子的摩尔质量都是以“克/摩”为单位,在数值上等于该粒子的相对原子质量或相对分子质量。
【举例】 Mg的摩尔质量:24 g/mol, Na的摩尔质量:23 g/mol,Ag的摩尔质量:108 g/mol ,CO2的摩尔质量:44 g/mol,CaCO3的摩尔质量:100 g/mol, KCl摩尔质量:74.5 g/mol,CO32-摩尔质量:60 g/mol。
【课堂练习】回答下列问题:
(1)O2的摩尔质量是多少?2mol O2质量是多少?
(2)H2SO4的摩尔质量是多少?0.5 mol H2SO4质量是多少?
回答:(1) ![]() ;2mol O2质量是64g。(2)
;2mol O2质量是64g。(2) ![]() ;0.5 mol H2SO4质量是49 g。
;0.5 mol H2SO4质量是49 g。
【过渡】通过计算同学们可以发现,物质的质量与物质的量之间有什么关系?
【学生探究】物质的量(n)、摩尔质量(M)之间的关系之间的关系。
[板书]6、物质的质量与物质的量之间的关系:

![]()
[明辨是非]判断以下说法是否正确,并指明原因。
①1 mol O2原子的质量是 32g/mol;
②OH_的摩尔质量是17g ;
③1 mol H2O的质量是18g/mol ;
④CO2的摩尔质量是44g/mol。
〖学与问〗1、24.5克H2SO4硫酸的物质的量是多少?1.50 mol的Na2CO3的质量是多少?
2、在Na2CO3固体中,钠原子和氧原子的物质的量与的物质的量有何关系?
〖过渡〗下面我们轻松一下,欣赏几幅图片。
【问题】桥梁在我们的生活的作用是什么?结合下面的关系图分析,它给我们的启示是什么?
【图片展示】几个世界或国内大桥的图片。
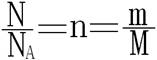
[讲述]根据物质的质量和摩尔质量可求出物质的量,反之根据物质的量和摩尔质量也可求出物质的质量。同时还可以通过计算知道一定质量的物质中所含的粒子数。这样通过物质的量,我们就可以顺利的从宏观物质到微观粒子或者从微观粒子到宏观物质。
【板书】物质的量像一座桥梁,将微观粒子和宏观物质联系在一起。我们可以通过控制宏观物体的质量达到控制粒子数目的目的,从而给研究某些问题和化学计算带来了极大的方便。
【学以致用】
1、现有90g水,它的物质的量是多少?含有多少个水分子?
2、现有2.41×1024个SO2分子,其质量是多少?
3、有53g Na2CO3样品,其中Na+、CO32-、O的物质的量分别是多少?
4、取5.6克某碳的氧化物,经测定其物质的量为0.2mol,试通过计算确定其化学式。
【小结】
一、物质的量
1、物质的量:①含义:表示构成物质的微观粒子多少的物理量。它表示含有一定数目粒子的集合体。 ②符号:n ③单位:摩尔(mol)
2、摩尔:摩尔是物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒。摩尔简称“摩”,符号为 “mol”。
3、阿伏加德罗常数:0.012kg12C所含的碳原子数叫做阿伏加德罗常数。通常用近似值6.02×1023mol-1 。符号:NA 单位:mol-1
1mol任何粒子含有阿伏加德罗常数个微粒;含有阿伏加德罗常数个微粒的集合体的物质的量都是1mol。
4、物质的量和微粒个数的关系:
![]() n=N / NA (N为粒子数)
n=N / NA (N为粒子数)
【推论】:
①物质的物质的量相同,粒子数就相同。
②物质的物质的量之比,等于粒子数之比。
5、摩尔质量:①定义:单位物质的量的物质所具有的质量叫做摩尔质量。
②摩尔质量的符号为:M;③单位: (克/摩)g/mol
④规律:物质的摩尔质量都是以 “克/摩尔”为单位,在数值上与该粒子的相对原子质量或相对分子质量相等。
6、物质的质量与物质的量之间的关系:

![]()
【教后记】
上一篇:第二节 化学计量在实验中的应用(1)
下一篇:第二节 化学计量在实验中的应用(3)
