第六单元 非金属及其化合物(4.1)
2015-11-16 10:46:44 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第六单元 非金属及其化合物(4.1)
|
|
|
授课人:董 啸 |
|
|
①掌握氮族元素的结构特点以及物理性质和化学性质。 |
|
|
教学目标: |
②掌握氮和氮的化合物的化学性质及制法和用途。 |
|
|
|
③了解磷及其化合物的性质和用途。
|
|
|
教学重点: |
氮气、氨气、硝酸的化学性质 |
|
|
教学难点: |
氮的氧化物及硝酸的有关计算 |
|
|
教学方法: |
分析引导法,讲练结合 |
|
|
教学过程: |
|
|
基础知识精析
一、氮族元素
1、包含元素:氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)
2、周期表中位置:ⅤA族,第二~六周期
3、原子结构的特征:最外层均为5个电子,电子层数依次增多,原子半径依次增大,得电子能力逐渐减弱,失电子能力逐渐增强。
4、物理性质:密度逐渐增大,熔点先升后降。
5、化学性质:
(1)相似性:
①化合价:+5,-3
②最高价氧化物:R2O5、HRO3、H3RO4;氢化物:RH3
(2)递变性:氮族元素的非金属性逐渐减弱,金属性逐渐增强;氢化物的稳定性逐渐减弱,最高阶含氧酸的酸性逐渐减弱。
二、氮的单质及氧化物
1.氮气:
(1)分子结构:N≡N
(2)物理性质:
① 无色、无味气体;密度比空气略小,-195.8℃(沸点)变成无色液体,-209.86℃(熔点)变成雪花状固体。
② 溶解性:难溶于水。1∶0.024 (Cl2:1∶2.0; 20℃时,O2:0.03 )
(3) 氮气的化学性质:
通常情况下,氮气化学性质很不活泼。氮原子有很高的化学活泼性,但氮气结构稳定,化学性质稳定。 因为氮分子中叁键键能很大。甚至在高达3000℃时,还不能觉察到它的解离作用。因此,氮分子是已知双原子单质分子中最稳定的。 特殊条件下,氮气可以发生以下化学反应:
①与氢气的反应(工业制氨):
![]()
② 与氧气反应: N2 +O2 ![]() 2NO
2NO
③ 跟某些金属反应:
高温下,氮气能跟Mg、Ca、Sr、Ba(ⅡA族)及Al等反应生成金属氮化物。
3Mg+N2 ![]() Mg3N2 (淡黄色)
Mg3N2 (淡黄色)
镁在空气中燃烧,除生成MgO外,也生成少量Mg3N2。
3Ca+N2 ![]() Ca3N2 3Al+N2
Ca3N2 3Al+N2 ![]() Al3N2
Al3N2
注意:金属氮化物是离子化合物,但不是盐。因为金属氮化物与水反应会生成氢氧化物和氨气,而不是碱和酸。如:Mg3N2 +6H2O == 3Mg(OH)2+2NH3
小结:氮气是常温稳定,高温活泼。跟氢、金属(具有还原性)反应时显-3价,作氧化剂;跟氧气(具有氧化性)反应时显+2价,作还原剂。
(4) 氮气的制法:
①工业制法:液化空气:先液化,后蒸发,为的是除去Ar。燃氧法:水煤气。
② 实验室制法:
A、实验室可用加热饱和NH4Cl溶液和固体NaNO2混合物制备。
NH4Cl+NaNO2 = NaCl+NH4NO2 NH4NO2 ![]() N2↑+2H2O
N2↑+2H2O
B、2NH3+3CuO ![]() N2↑+3H3O+3Cu,因此,要除去氨气中混有的氧气用加热的铜粉就不好。
N2↑+3H3O+3Cu,因此,要除去氨气中混有的氧气用加热的铜粉就不好。
(5) 氮气的用途:
① 合成氨的原料;氮是庄稼的“三大要素”,氮的固定有天然固氮和人工固氮。
② 化工原料;
③ 作保护气,充填灯泡,(N2或N2+Ar) 保存粮食、水果。(利用惰性)
(6)氮的固定:
①定义:将游离态的氮转化为化合态的氮的过程叫做氮的固定。
②分类:天然固氮和人工固氮。
2.氮的氧化物:
氧化物种类:N2O( g ) 无色、NO( g ) 无色、N2O3( g ) 暗蓝色亚硝酐、NO2( g ) 红棕色、N2O4( g ) 无色、N2O5 ( s ) 白色硝酐。
(1) 一氧化氮:NO
①物理性质:无色气体;难溶于水;比空气重(r = 1.34 g / L)。
②化学性质: 不成盐氧化物;易氧化:2NO+O2 = 2NO2 。
③实验室制法:3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
(2) 二氧化氮:NO2
![]()
① 物理性质:红棕色、有剌激性气味气体,有毒;比空气重。
② 化学性质:
易溶于水,3NO2+H2O = 2HNO3+NO↑。所以,NO2不是HNO3的酸酐,HNO3的酸酐是N2O5。NO2冷却,颜色变浅,生成N2O4。
2NO2 (棕色)![]() N2O4(无色)
N2O4(无色)
N2O4 ![]() 2NO2
2NO2 ![]() 2NO+O2
2NO+O2
无色 棕色 无色
NO2有很强的氧化能力,S、P、C等物质都可以在NO2中燃烧。

NO和NO2的混合物可看作亚硝酐N2O3,
NO+NO2 = N2O3 DH=- 41.8 kJ
NO+NO2 +H2O = 2HNO2(亚硝酸不稳定,仅存在于水溶液中,弱酸,比醋酸略强,氧化性强于还原性。)
注意:NO2 和N2O4的相互转化反应是高考的热点内容,特别是有关化学平衡和气体相对分子质量的问题。
③二氧化氮的制法:
工业制法:2NO+O2 = 2NO2
实验室制法:Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O
![]() 深度思考
深度思考![]()
1.根据氮在元素周期表中的位置可知氮元素是一种活泼的非金属,为什么氮气很稳定?
答案:氮气的性质不仅与原子结构有关,还与氮分子的构成有关;氮气分子中的N≡N键,键能很大,分子结构稳定,故氮气很稳定。
2.俗话说“雷雨发庄稼”,这说明雷雨中含有能被植物吸收利用的化合态的氮,请同学们写出三个有关的化学方程式:
①_______________________________________________________;
②_______________________________________________________;
③_______________________________________________________。
答案:①N2+O22NO;②2NO+O2=2NO2;③3NO2+H2O=2HNO3+NO
3.如何鉴别NO2与溴蒸气?
答案 由于NO2和Br2在性质上有不少相似性:①均具有氧化性;②溶于水均有酸生成;③均可与碱反应;④均为红棕色等。所以不能用淀粉KI试纸、pH试纸、NaOH溶液来鉴别,但二者性质又有差别,可以用下列方法鉴别:①AgNO3溶液;②CCl4溶液;③用水洗法。
题组一 NO、NO2的性质及对环境的影响
1.下列说法正确的是 ( )
A.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.NO可用于某些疾病的治疗
C.NO2通入FeSO4溶液中始终无明显现象
D.汽车尾气的主要污染成分包括NO、CO和N2
答案 B
解析 NO易被氧化为NO2,N2不是污染物,NO2通入溶液中生成HNO3,能把
Fe2+氧化成Fe3+,溶液由浅绿色变成棕黄色。
2.汽车排放的尾气中含有NO2,NO2是城市大气污染的主要污染物之一,在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为①2NO2―→2NO+2O,②2NO+O2―→2NO2,③O+O2―→O3。下列对该反应过程及产物叙述正确的是 ( )
A.NO2起催化剂作用 B.NO起催化剂作用
C.NO2只起氧化剂作用 D.O3与O2为同分异构体
答案 A
解析 反应过程①+②得O2―→2O,③O+O2―→O3,NO2起催化剂作用,反应过程中NO2作氧化剂,A项正确,B、C项错误;O3与O2的相对分子质量不相同,不是同分异构体,属同素异形体,D项错误。
3.N2O俗称“笑气”,曾用作可吸入性麻醉剂。以下反应能产生N2O:3CO+2NO23CO2+N2O。下列关于N2O的说法正确的是 ( )
A.上述反应中每生成1 mol N2O,消耗1.5 mol CO
B.等物质的量的N2O和CO2含有相等的电子数
C.N2O只具有氧化性,无还原性
D.N2O会迅速与人体血红蛋白结合,使人中毒
答案 B
解析 由方程式知,生成1 mol N2O时消耗3 mol CO,A错误;1 mol N2O与1 mol CO2都含有22 mol电子,B正确;N2O中氮元素为+1价,是氮元素的中间价态,所以N2O既具有氧化性又具有还原性,C错误。
题组二 有关氮的氧化物计算类试题
4.如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,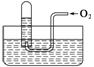 但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的气体是 ( )
但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的气体是 ( )
A.可能是N2与NO2的混合气体
B.只能是O2与NO2的混合气体
C.可能是NO与NO2的混合气体
D.只能是NO2一种气体
答案:C
解析:解答本题要注意以下两点:(1)明确氮气不溶于水,且常温下不与其他物质发生化学反应;(2)NO2可与水反应生成不溶于水的NO,NO2和NO与氧气按适当的比例被水完全吸收。
5.将容积为50 mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5 mL。则原混合气体中NO2和O2体积比可能是__________或________。
答案:18∶7 43∶7
解析:NO或NO2与O2混合气体与水的反应计算关系式可由下列化学方程式推导出来。
4NO2+O2+2H2O===4HNO3 4NO+3O2+2H2O===4HNO3
设剩余的5 mL气体为O2,则参加反应③的NO2和O2的总体积为50 mL-5 mL=45 mL
则原混合气体里,NO2的体积为45 mL×4/5=36 mL
O2的体积为50 mL-36 mL=14 mL
即NO2与O2的体积比为36∶14=18∶7。
设剩余的5 mL气体为NO,由②式得过量的NO2体积为15 mL,则发生反应③的NO2和O2的总体积为50 mL-15 mL=35 mL
则原混合气体里,O2的体积为35 mL×1/5=7 mL,NO2的体积为50 mL-7 mL=43 mL
即NO2与O2的体积比为43∶7。
三、氨和铵盐
1.氨:NH3
(1)氨分子的结构:N-H键是极性键;NH3呈三角锥形,键角:107°18¢,键长:1.02×10-10 m。
![]()
![]()
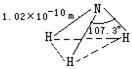
(2)氨气的物理性质
无色、剌激性气味的气体;密度比空气小;易液化,故可作制冷剂;易溶于水。氨水是混合物;氨水浓度越大,密度越小。
注意:a. 易液化的气体有:CO2、Cl2、SO2、NH3。
b. 装液态气体的钢瓶颜色:Cl2 绿色;O2 蓝色;NH3 黄色;N2 黑色;CO2 黑色。
(3)氨气的化学性质
① 跟水反应:
NH3+H2O ![]() NH3·H2O
NH3·H2O ![]()
![]() +OH-
+OH-
NH3·H2O ![]() NH3↑+H2O
NH3↑+H2O
故实验室也可以用浓氨水加热制氨气。
注意:① 氨易溶于水,② 氨水呈弱碱性,③ 氨水中,有H2O、NH3、NH3·H2O、、OH-、(H+),主要成分是NH3·H2O,故氨水应写为NH3·H2O,而不能写成NH3或NH4OH;但氨水中溶质为NH3,而非NH3·H2O,正如CuSO4·5H2O溶于水后溶质为CuSO4一样。
② 跟酸反应
NH3+HCl=NH4Cl;NH3+HNO3=NH4NO3;2NH3+H2SO4=(NH4)2SO4
注意:浓氨水与浓盐酸或浓硝酸靠近会冒烟。
NH3+CO2+H2O===NH4HCO3或2NH3+CO2+H2O===(NH4)2CO3
③ 跟氧气反应(催化氧化):
4NH3+5O2催化剂△4NO+6H2O
氨的催化氧化实验的现象是:催化剂发红,锥形瓶内气体颜色变红,石蕊试液变红。
实验结论: 生成NO2,若是白烟,则生成NH4NO3;放热。
氨气在空气中不能燃烧,在纯氧中燃烧为黄色火焰,生成N2。
4NH3+3O2 (纯) ![]() N2+6H2O
N2+6H2O
④与盐溶液反应
与FeCl3溶液反应:Fe3++3NH3·H2O===Fe(OH)3↓+3NH
与AlCl3溶液反应:Al3++3NH3·H2O===Al(OH)3↓+3NH
(3) 氨气的实验室制法:
①制取:
a.铵盐与强碱反应:碱一般用Ca(OH)2,不用NaOH,因为后者易潮解成本高。
Ca(OH)2+2NH4Cl ![]() CaCl2+2H2O+2NH3↑(不能写离子方程式)
CaCl2+2H2O+2NH3↑(不能写离子方程式)
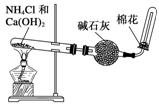
实验中注意:①反应物混合均匀,②管底比管口稍高,③向下排空气法,瓶口塞棉花防空气中水蒸汽的进入。
b.浓氨水加热法:NH3·H2ONH3↑+H2O
②检验氨气:润湿的红色石蕊试纸;浓盐酸。
③干燥氨气:用碱石灰,不能用浓硫酸、CaCl2(因为生成CaCl2·8NH3)
④收集:向上排空气法
(4)氨气的用途:① 致冷剂,② 化工产品。
2.铵盐:
(1)物理性质:晶体,能溶于水。
(2)化学性质:
①铵盐受热分解
NH4Cl ![]() NH3↑+HCl↑
NH3↑+HCl↑
NH3+HCl = NH4Cl
NH4HCO3 ![]() NH3↑+H2O↑+CO2↑
NH3↑+H2O↑+CO2↑
铵盐受热时,一般放出氨气。但硫酸铵、磷酸铵稳定,硝酸铵分解情况复杂。
②铵盐跟碱反应
(NH4)2SO4+2NaOH ![]() Na2SO4+H2O↑+2NH3↑
Na2SO4+H2O↑+2NH3↑
(3)铵盐的用途:
① 作氮肥,② 硝铵炸药,③ NH4Cl用于印染、干电池、金属焊接。
(4)检验![]() :
:
未知液呈碱性湿润的红色石蕊试纸变蓝色,则证明含NH。
![]() +OH-
+OH- ![]() NH3↑+H2O↑
NH3↑+H2O↑
题组一 氨及铵盐的性质
1、判断下列说法是否正确,不正确的说明理由。
①氨气溶于水能导电,所以氨气是电解质。
②实验室用浓氨水与NaOH固体制取氨气。
③氨和酸反应生成铵盐,与挥发性酸相遇时能形成白烟。
④某晶体与NaOH共热放出一种使湿润的红色石蕊试纸变蓝的气体,该晶体中含有NH。
⑤氨水中含氮微粒中最多的微粒是NH。
⑥把NH3通入稀HNO3中,当溶液的pH等于7时,溶液中NH3和HNO3等物质的量反应。
⑦液氨作为清洁能源的反应原理是4NH3+5O2催化剂△4NO+6H2O。
⑧氨水中物质的量浓度最大的粒子是NH3·H2O(除水)。
⑨在1 mol·L-1氨水中,NH3·H2O、NH、NH3的物质的量浓度之和为1 mol·L-1。
答案 ②③④⑧⑨正确。①不正确,NH3本身不导电,溶于水,与水发生反应NH3+H2O=NH3·H2O=NH+OH-而导电,故NH3不是电解质;⑤不正确,氨水中存在大量的NH3·H2O和少量的NH;⑥不正确,NH3和HNO3等物质的量反应时,得到NH4NO3溶液,NH水解使溶液显酸性,pH<7;⑦不正确,产生的NO是污染气体。
2.下列反应中说明NH3既有还原性,又有碱性的是 ( )
A.4NH3+5O2催化剂△4NO+6H2O
B.NH3+HNO3===NH4NO3
C.8NH3+3Cl2===N2+6NH4Cl
D.2NH3+3CuO3Cu+N2+3H2O
答案:C
解析 在A、D两项中,参加反应的NH3全部被氧化,NH3只体现还原性;B项反应为非氧化还原反应,NH3只体现碱性;C项中参加反应的8 mol NH3有2 mol被氧化,NH3既体现碱性又体现还原性。
3.氯化铵和氯化钠可用下列哪一种方法分离 ( )
A.加入氢氧化钠 B.加入AgNO3溶液
C.加热法 D.加入一种合适的酸
答案 C
解析 分离可根据物理性质用物理方法进行分离,比如根据各组分的溶解性不同,用过滤的方法分离;根据各组分的沸点不同,用蒸馏的方法分离;根据各组分在同一溶剂中的溶解度不同,用结晶的方法分离。也可根据各组分的化学性质不同,加入某些试剂,采取一定的化学方法进行分离。根据以上分析,题目所给NaCl和NH4Cl只能用化学方法分离,又因为两种物质中都含Cl-,所以加AgNO3或加酸都起不到分离的作用,加入NaOH,只能鉴别NH4Cl和NaCl,而达不到分离的目的。利用铵盐的不稳定性及NH3的化学性质,可以选用加热法。
题组二 氨气及铵盐的性质实验
4.已知气体的摩尔质量越小,扩散速度越快。如图所示为气体扩散速率的实验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是 ( )
![]() A.甲是浓氨水,乙是浓硫酸
A.甲是浓氨水,乙是浓硫酸
B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸
D.甲是浓硝酸,乙是浓氨水
答案 C
解析 A项中浓H2SO4不是挥发性酸,不会产生白色烟环;B、C、D三项中由于NH3的摩尔质量小,扩散速度快,所以离白色烟环远的甲为浓氨水,故C正确。
5.利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是 ( )

|
选项 |
实验现象 |
解释 |
|
A |
浓盐酸附近产生白烟 |
NH3与浓盐酸反应产生了NH4Cl固体 |
|
B |
浓硫酸附近无明显现象 |
NH3与浓硫酸不发生反应 |
|
C |
氯化物溶液变浑浊 |
该溶液一定是AlCl3溶液 |
|
D |
干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 |
NH3是一种可溶性碱 |
答案 A
解析 NH3能与HCl发生化合反应,生成NH4Cl白色固体,NH3也能与H2SO4发生化合反应,生成(NH4)2SO4;NH3与氯化物溶液反应生成氢氧化物沉淀,该氯化物可以是氯化铝、氯化镁等;NH3溶于水生成NH3·H2O,NH3·H2O是一种可溶性碱,NH3是氢化物。
 6.右图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是 ( )
6.右图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是 ( )
A.CO2(NaHCO3溶液)/无色喷泉
B.NH3(H2O中含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉
D.HCl(AgNO3溶液)/白色喷泉
答案 A
解析 CO2在NaHCO3溶液中的溶解度很小,因此不能形成喷泉;NH3极易溶于水生成NH3·H2O,NH3·H2O发生电离生成OH-,遇酚酞使之显红色;H2S和CuSO4反应生成CuS黑色沉淀;HCl极易溶于水,且和AgNO3发生反应生成白色沉淀;因此A不正确。
7.某研究性学习小组同学设计如下图所示装置探究氨气的还原性。
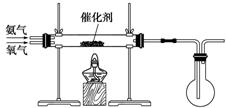
(1)氨催化氧化的化学方程式为_________________________。
(2)若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为__________。
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。请选择合适的方案并说明原因。
答案:(1)4NH3+5O2催化剂△4NO+6H2O (2)NH4NO3
(3)乙同学方案正确;CO2在水中溶解度小,先通CO2再通NH3生成的NH4HCO3的量少,而且易生成(NH4)2CO3,先通NH3至饱和再通CO2至过量,保证产物量大,且全部是NH4HCO3溶液。
题组三 氨气的实验室制法
8.下图所示是实验室制取氨气的装置和选用的试剂,其中错误的是______。
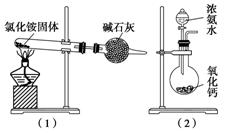
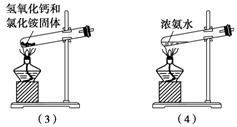
答案 (1)(3)
解析 实验室制取氨气的方法有:①铵盐与碱加热制取氨,常用固体NH4Cl与Ca(OH)2反应,试管口向下倾斜;②在浓氨水中加CaO,放热促进氨水分解为氨气;③加热浓氨水,加快氨水分解为氨气。
(1)错在直接加热氯化铵(NH4Cl分解生成的NH3和HCl在试管口又冷凝成NH4Cl);(3)错在试管口向上倾斜。
〖教后记〗
相关热词搜索:
上一篇:第六单元 非金属及其化合物(3.2)
下一篇:第六单元 非金属及其化合物(4.2)
