第六单元 非金属及其化合物(3.2)
2015-11-16 10:45:56 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第六单元 非金属及其化合物(3.2)
|
|
|
授课人:董 啸 |
|
|
①了解碳族元素性质及递变规律,掌握碳及化合物的性质;
|
|
|
教学目标: |
②掌握硅、二氧化硅的重要性质和主要用途;
|
|
|
|
③运用元素周期律知识学习碳族元素性质及其递变规律。 |
|
|
教学重点: |
碳族元素性质及递变规律 |
|
|
教学难点: |
金刚石、晶体硅、二氧化硅的结构 |
|
|
教学方法: |
分析比较法 |
|
|
教学过程: |
第二课时 |
|
基础知识精析
三、硅及其化合物
1、硅
(1)硅元素的含量与存在
在地壳里,硅的含量在所有元素中居第二位,仅次于氧,全部以化合态形式存在,是构成矿物和岩石的主要元素。
(2)硅晶体的结构与主要物理性质
原子晶体,正四面体的空间网状结构;灰黑色,有金属光泽;硬度较大,熔点和沸点较高,但都低于金刚石。
(3)硅的化学性质
不活泼,在常温下,除F2、HF、强碱溶液外,与其他物质如O2、H2、C12、硫酸、硝酸等都不起反应。
Si+2NaOH+H2O==Na2SiO3+2H2
Si+2F2==SiF4 Si+4HF=SiF4+2H2
(4)高纯硅的制法
①SiO2+2C=Si+2CO↑(制粗硅)
②Si+2C12==SiCl4(提纯)
③SiCl4+2H2== Si+4HCl(提纯)
(5)用途:
①用来制造集成电路晶体管等半导体材料
②硅合金用来制变压器铁芯
③硅钢用来制耐酸设备
题组一 新材料、新技术下C、Si的考查
1.下列关于硅的说法中,不正确的是 ( )
A.硅是人类将太阳能转换为电能的常用材料
B.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C.硅的化学性质不活泼,常温下不与任何物质反应
D.加热到一定温度时,硅能与氯气、氧气等非金属反应
 答案 C
答案 C
2.石墨烯的结构示意图如图所示,下列关于石墨烯的叙述正确的是( )
A.石墨烯可导电,说明它是电解质
B.石墨烯、金刚石、C60、“碳纳米泡沫”四种物质都是碳
的单质
C.由于C(石墨,s)===C(金刚石,s) ΔH=+1.9 kJ·mol-1知金刚石比石墨烯稳定
D.尽量使用含C的产品,减少使用含C的产品,此举符合“促进低碳经济”的宗旨
答案 B
题组二 工业制取高纯硅
3.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
ⅰ.高温下用碳还原二氧化硅制得粗硅
ⅱ.粗硅与干燥HCl气体反应制得SiHCl3:Si+3HClSiHCl3+H2
ⅲ.SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第ⅰ步制备粗硅的化学反应方程式为_____________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①装置B中的试剂是___________。装置C中的烧瓶需要加热,其目的是_________。
②反应一段时间后,装置D中观察到的现象是_______________,装置D不能采用普通玻璃管的原因是___________________________________,装置D中发生反应的化学方程式为__________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及__________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是______________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
答案 (1)SiO2+2CSi+2CO↑(2)分馏(或蒸馏)
(3)①浓硫酸 使滴入烧瓶中的SiHCl3气化
②有固体物质生成 在反应温度下,普通玻璃会软化
SiHCl3+H2Si+3HCl
③排尽装置中的空气 ④bd
2、氧化硅(SiO2)
(1)晶体结构:
晶体二氧化硅是硅原子和氧原子以共价键形成的原子晶体,因此硬度大,熔、沸点高,不导电,难溶于水。
(2)物理性质:
天然SiO2分为晶体和无定形两大类。石英的主要成分是SiO2,自然界透明的六方柱状石英晶体,即水晶;天然产SiO2又叫硅石;无定形SiO2有硅藻土。
(3)化学性质:
具有酸性氧化物的性质
①与碱性氧化物、强碱等反应:
SiO2+CaO ==CaSiO3 SiO2+Na2CO3===Na2SiO3+CO2↑
SiO2+2NaOH=Na2SiO3+H2O(盛放碱溶液的试剂瓶常用塑料瓶,不用玻璃塞)
②与弱酸HF的反应:
SiO2+4HF==SiF4+2H2O(HF腐蚀玻璃)
③氧化性:SiO2+2C ==Si+2CO↑
(4)用途:制造电子部件、光学仪器、玻璃原料和光导纤和建筑材料等等。
【思考与交流】
①为什么不能用带玻璃塞的试剂瓶盛放碱液?
②SiO2既能和NaOH溶液反应又能和HF溶液反应,一定是两性氧化物吗?
③下列叙述正确的是( )
A.因为Na2CO3+SiO2Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.碳和硅都是ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似
C.二氧化硅既溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物
D.二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不能和水反应生成硅酸
题组一 二氧化硅的结构与性质
1.判断正误,正确的划“√”,错误的划“×”
(1)二氧化硅不与任何酸反应,可用石英制造耐酸容器 ( )(2011·江苏,3A)
(2)SiO2是酸性氧化物,能与NaOH溶液反应 ( )(2010·山东理综,13A)
(3)二氧化硅是生产光纤制品的基本原料 ( )(2010·江苏,4A)
(4)二氧化硅的分子式是SiO2 ( )(2010·上海,2B)
答案 (1)× (2)√ (3)√ (4)×
2.指出下列反应中SiO2所表现的化学性质或作用,在A~E选项中选择正确答案填入括号内。
(1)SiO2+2NaOH===Na2SiO3+H2O ( )
(2)SiO2+Na2CO3Na2SiO3+CO2↑ ( )
(3)SiO2+2CSi+2CO↑ ( )
(4)SiO2+3CSiC+2CO↑ ( )
(5)SiO2+4HF===SiF4↑+2H2O ( )
A.作为玻璃的成分被消耗而使玻璃被腐蚀 B.氧化性
C.酸性氧化物的通性 D.将挥发性的酸酐从其盐中置换出来
E.未参加氧化还原反应
答案 (1)C (2)D (3)B (4)E (5)A
解析 本题较全面考查SiO2的性质,将所给选项结合实际一一对应查找,A用来雕刻玻璃,应有氢氟酸(HF)参与反应;B中氧化性是指反应中SiO2中Si得电子,化合价降低;D中挥发性酸酐,应为CO2而不是CO;C中表现酸性氧化物通性是指SiO2与碱的反应。
题组二 二氧化碳与弱酸盐溶液反应的规律
3.用四种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
|
选项 |
操作及现象 |
溶液 |
|
A |
通入CO2,溶液变浑浊,再升温至65 ℃以上,溶液变澄清 |
C6H5ONa溶液 |
|
B |
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 |
Na2SiO3溶液 |
|
C |
通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 |
Ca(ClO)2溶液 |
|
D |
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 |
Ca(OH)2溶液 |
答案 B
解析 A项,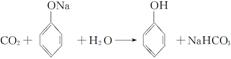 ,升温至65 ℃以上,C6H5OH完全溶解,溶液变澄清;B项,CO2+Na2SiO3+H2O===Na2CO3+H2SiO3↓,H2SiO3与CO2不反应,浑浊不会消失;C项,CO2+Ca(ClO)2+H2O===CaCO3↓+2HClO,溶液变浑浊后加入品红溶液,被HClO氧化褪色;D项,首先CO2+Ca(OH)2===CaCO3↓+H2O,继续通CO2,生成可溶于水的Ca(HCO3)2,再加入足量的NaOH,则:2NaOH+Ca(HCO3)2===CaCO3↓+Na2CO3+2H2O,溶液又变浑浊。
,升温至65 ℃以上,C6H5OH完全溶解,溶液变澄清;B项,CO2+Na2SiO3+H2O===Na2CO3+H2SiO3↓,H2SiO3与CO2不反应,浑浊不会消失;C项,CO2+Ca(ClO)2+H2O===CaCO3↓+2HClO,溶液变浑浊后加入品红溶液,被HClO氧化褪色;D项,首先CO2+Ca(OH)2===CaCO3↓+H2O,继续通CO2,生成可溶于水的Ca(HCO3)2,再加入足量的NaOH,则:2NaOH+Ca(HCO3)2===CaCO3↓+Na2CO3+2H2O,溶液又变浑浊。
4.下列实验过程中,始终无明显现象的是 ( )
A.NH3通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.AlCl3溶液中滴入NaHCO3溶液 D.向饱和碳酸钠溶液中通入过量的CO2
答案 B
3、硅酸、硅酸盐性质
(1)硅酸:
①性质:不溶于水、弱酸,其酸性比碳酸还要弱。
Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓
H2SiO3+2NaOH==Na2SiO3+2H2O
②制法:Na2SiO3+2HCl==2NaCl+H2SiO3
(2)硅酸盐:
是指含有金属元素、Si元素、氧元素的一类物质。如Na2SiO3(水溶液俗称水玻璃)。 硅酸盐组成的氧化物形式:
硅酸钠:Na2SiO3 石棉:3MgO·CaO·4SiO2 正长石:K2O·、A12O3·6SiO2
普通玻璃:Na2O·CaO·6SiO2 水泥主要成分:3CaO·SiO2,2CaO·SiO2,3CaO·A12O3 黏土的主要成分:A12O3·2SO2·2H2O
硅酸钠(Na2SiO3):
①白色、可溶于水的粉末状固体,其水溶液俗称水玻璃,有黏性,水溶液显碱性。
②它能与酸性较硅酸强的酸反应,化学方程式分别为
与盐酸反应:Na2SiO3+2HCl=2NaCl+H2SiO3↓。
与CO2水溶液反应:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3。
③用途:黏合剂(矿物胶),耐火阻燃材料。
(3)硅酸盐工业
Ⅰ、水泥:
①原料:石灰石和黏土。
②生产设备:水泥回转窑。
③主要成分:3CaO·SiO2、2CaO·SiO2、3CaO·A12O3。
水泥是一种混合物,它的水硬过程是一个复杂的物理化学过程。
Ⅱ、玻璃:
①原料:纯碱、石灰石和石英。
②生产设备:玻璃融炉。
③反应原理:
Na2CO3+SiO2==Na2SiO3+CO2↑;CaCO3+SiO2=CaSiO3+CO2↑。
【思考与交流】反应①Na2SiO3+H2O+CO2===Na2CO3+H2SiO3↓,说明H2CO3的酸性强于H2SiO3。反应②Na2CO3+SiO2Na2SiO3+CO2↑,能否说明H2SiO3的酸性强于H2CO3?
④主要成分:Na2SiO3、CaSiO3、SiO2。
【说明】玻璃不是晶体,它没有固定的熔点。
Ⅲ、陶瓷
①主要原料:黏土
②主要生产过程: 混合—成型—干燥—烧结—冷却
③主要设备:陶瓷窑
④主要性质:抗氧化,抗酸碱腐蚀,耐高温,绝缘,易成型等。
Ⅳ、新型无机非金属材料
(1)传统无机非金属材料:是指硅酸盐无机非金属材料。
(2)新型无机非金属材料:新开发利用的如氮化硅(Si3N4)、刚玉(A12O3)等陶瓷,光导纤维等无机非金属材料。这些材料具有特殊结构、特殊功能,如半导体材料,超硬耐高温材料,发光材料等,都称为新型无机非金属材料。
高考考点透析
一、考纲要求
(1)了解这些元素的单质及某些氧化物、氢化物的性质。
(2)了解硫、氮、碳的氧化物对大气的污染及其防治。
(3)了解常见盐类的性质和用途。
二、考点透析
命题趋势:对于本章内容,命题特点偏向于综合性及新颖实用性。综合性表现为:单纯只涉及本章内容的考题出现得比较少,常见的是将本章知识与晶体结构、元素周期律、非金属元素知识、离子方程式及实验等内容综合在一起。新颖实用性是因为近年来的考试注重考查学生的创新思维能力及理论联系实际的能力,所以要求学生在掌握本章内容的基础上扩大知识面,并注重所学知识与生产、生活、社会的联系。本章中重要的高考题型一类是综合考查学生的“双基”知识。解这一类题要求学生对基本概念和基础理论的掌握准确无误、概念清晰,这一类题一般放在选择题中,属于难度较低的题型。
试题类型:本章知识与生产生活相结合,引入新信息和新的科技成果,考查学生的综合能力,这一类题型难度较大,对学生的能力要求也较高.这一类试题靠死记硬背是没有用的,解这一类题应注意以下几点:1.认真阅读题目所给信息,并从中筛选出有用的内容;2.准确判断题目要考查的是哪几方面的知识点,3.理论联系实际.注意可行性及合理性;4.打破定势思维,做合理的创新。
本章今后的命题方向估计有以下几个方面:a.综合考查“双基”知识。通过本章知识与其他知识点之间的联系,综合考核学生的基本概念和基本理论。这一类题的难度不会太大;b.在本章内容的基础上引入新知识、新信息及新的科技成果,考查学生的创造性思维能力,命题向开放性发展。
命题形式:以选择题的形式考查C、CO的还原性;以填空题的形式考查CO、CO2的检验与鉴别;以计算题的形式考查CO2与Na0H反应产物的确定计算;含碳化合物的综合计算;以选择题考查Si及其化合物的性质用途;以选择题考查新型无机非金属材料的特性;以选择题考查高温结构陶瓷和光导纤维的特点和用途。
〖教后记〗
相关热词搜索:
上一篇:第六单元 非金属及其化合物(3.1)
下一篇:第六单元 非金属及其化合物(4.1)
