|

1.知识与技能
(1)化学平衡常数在生产生活中的定量应用;
(2)化学平衡常数与反应限度的关系;
(3)利用浓度商Q和K的关系判断反应是否达到化学平衡状态,以及反应的进行方向。
2.过程与方法
课前通过微视频和学案导学的方式引发学生思考,课堂上通过师生交流讨论的方式深入体会化学平衡常数的功能与价值。
3.情感态度与价值观
(1)借助化学平衡常数更理性地建立化学平衡概念,分析平衡移动的原因,形成定量观。
(2)体会化学平衡常数在生产生活中的重要指导意义。

【化学平衡常数的应用一】将定性问题定量化,在实际生产生活中有重要应用
1.学案反馈、讨论问题一,体会化学平衡常数在定量调控工业生产方面的作用。
2.拓展生活中的化学。
煤气泄露能致人中毒。其原因是CO与血红蛋白(Hb)结合成Hb·CO,使血红蛋白失去输送O2的功能。CO进入血液后有如下平衡:CO+Hb·O2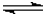 O2+Hb·CO,已知该反应平衡 O2+Hb·CO,已知该反应平衡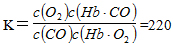 时,(在人体体温37℃下)。实验表明,Hb·CO的浓度即使只有Hb·O2浓度的2 %,也足以使人智力受损。试回答下列问题: 时,(在人体体温37℃下)。实验表明,Hb·CO的浓度即使只有Hb·O2浓度的2 %,也足以使人智力受损。试回答下列问题:
①家中发生煤气泄漏后,测得吸入肺部的空气中CO和O2的浓度分别为10-6 mol/L和10-2 mol/L。这时Hb·CO的浓度是Hb·O2浓度的多少倍?这时是否达到损伤人的智力的程度?
②假设血液中的氧浓度与进入肺的氧分压成正比。试问用怎样的方法来治疗一氧化碳中毒的患者是合乎逻辑的?请结合平衡移动原理回答。
【化学平衡常数的应用二】表征一定温度下可逆反应进行的程度
1.学案反馈、问题二。
2.课堂讨论
仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加, (选填字母)。
A.相同条件下,平衡时X2的转化率逐渐降低
B.相同时间内,生成HX的量逐渐减小
C.X元素的非金属性逐渐减弱
D.HX的稳定性逐渐减弱
【化学平衡常数的应用三】判断是否达到平衡状态及平衡移动的方向
1.提出问题:在判断平衡移动的方向时你觉得哪些情况更适合采用勒夏特列原理?哪些更适合采用Q与K的关系?能举出具体实例么?
2.学案反馈:问题三一题多解,体会利用勒夏特列原理与化学平衡常数在判断平衡移动时的异同。
3.方法迁移
①醋酸溶液中存在电离平衡:CH3COOH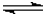 CH3COO–+H+,若加水稀释,平衡如何移动? CH3COO–+H+,若加水稀释,平衡如何移动?
②某温度下,恒压容器中发生反应:N2(g)+3H2(g) 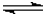 2NH3 (g),达到平衡时容器体积为1 L,三种物质的物质的量分别为1 mol、3 mol、2 mol,若此时再向容器中充入a mol N2,该平衡如何移动? 2NH3 (g),达到平衡时容器体积为1 L,三种物质的物质的量分别为1 mol、3 mol、2 mol,若此时再向容器中充入a mol N2,该平衡如何移动?
|


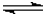 O2+Hb·CO,已知该反应平衡
O2+Hb·CO,已知该反应平衡