第二节 化学能与电能(第二课时)
2015-10-26 11:06:00 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第二节 化学能与电能(第二课时)
|
三维目标: |
|
|
|
①了解化学能与电能的转化关系及其应用。 |
|
知识与技能: |
②了解原电池的概念、原理及组成。 |
|
|
③掌握利用氧化还原反应将化学能转化成电能的装置。 |
|
过程与方法: |
①了解自主研究的基本方法。 |
|
|
②学会分析将化学能转化为电能的简单的方法。 |
|
情感、态度 |
①探究化学能转化为电能的奥秘,体验科学探究的艰辛与喜悦。 |
|
与价值观 |
②关注能源问题,逐步形成正确的能源观。 |
|
教学重点: |
初步认识原电池概念、原理、组成 |
|
教学难点: |
从电子转移角度理解化学能向电能转化的本质 |
|
教学方法: |
分析比较法、实验法、自主探究法 |
|
教学准备: |
多媒体课件、实验用品 |
|
教学过程: |
|
【引入】电能在我们的生活中发挥着重要作用,火力发电将化学能间接转化为电能,造成能量损耗而且不方便,能否通过某种方式将化学能直接转化为电能呢?今天我们就来通过探究来寻找答案。
二、化学能直接转换为电能
【探究主题】1、如何将化学能直接转换为电能?
(1)煤的燃烧是不是氧化还原反应?燃烧时主要将化学能直接转化为何种能量?
【合作探究】煤的燃烧就是煤和氧气发生化学反应,肯定是氧化还原反应;煤燃烧时,释放出大量的热量,所以主要将化学能直接转化为热能。
【探究结论】煤的燃烧是氧化还原反应;煤燃烧时,主要将化学能直接转化为热能。
【质疑】氧化还原反应的本质是氧化剂和还原剂之间发生电子转移;氧化还原反应过程中,电子转移引起化学键的重新组合,伴随着能量变化,一般是热量变化,却没有电流产生。
今天我们就从一个神奇的实验入手,探究如何把化学能直接转换为电能。
(2)如何使氧化还原反应释放的能量直接转化为电能?
【实验探究】
实验步骤:
①把一块锌片和铜片同时插入盛有稀硫酸的烧杯里,观察铜片上有无气泡产生(硫酸的体积约占烧杯的1/3,铜片和锌片不连接);
②把一块锌片和铜片同时插入盛有稀硫酸的烧杯里,用导线将锌片和铜片连起来,并在导线中接入一个电流表,观察铜片上有无气泡产生,电流表的指针是否偏转。
【观察】请同学们仔细观察,导线连接前后,实验现象有何不同。
实验现象:
①实验中,在锌片表面有气泡产生,在铜片表面没有气泡产生;
②实验中,电流表指针偏转,有电流产生,在铜片表面有气泡产生。
【思考】上述实验中能量发生什么变化?这个实验装置可以将化学能直接转变为电能吗?
【合作探究】从能量转变的角度分析,上述实验中能量变化是化学能转化为电能。这个装置就是一个直接将化学能转化为电能的装置,称为原电池。
【探究结论】
利用原电池装置可以将化学能直接转化为电能。
原电池:把化学能转化为电能的装置叫做原电池。
【历史】 1799年意大利的物理学家伏打 ,发明了世界上第一个电池——伏打电池,即原电池。
【过渡】原电池是如何产生电流的呢?让我们来继续探究一下原电池的原理。
【探究主题】2、原电池的工作原理是什么?
(1)铜片和锌片用导线连接后插入稀硫酸中,铜片与稀硫酸是否反应?为什么在铜片表面有气泡产生?
【实验数据】实验结束之后,称重发现铜片质量不变,锌片质量减小。
【合作探究】当把用导线连接的锌片和铜片一同浸入稀硫酸中时,由于锌比铜活泼,容易失去电子,锌被氧化成Zn2+而进入溶液,锌原子失去的电子由锌片通过导线流向铜片,溶液中的H+在铜片上获得锌片失去的电子被还原成氢原子,氢原子再结合成氢分子从铜片上逸出。
【探究结论】铜片与稀硫酸不反应;溶液中的H+在铜片上获得锌片失去的电子被还原成氢气逸出。
(2)请同学们从氧化还原反应的角度来分析,两个金属片上各发生了什么反应?电流是如何产生的呢?(物理学知识:电荷的定向移动形成电流。)
【合作探究】锌失去电子,发生氧化反应;铜片上H+获得电子,发生还原反应。在氧化还原反应中,锌片将失去的电子经过导线转移给铜片上H+,电子发生定向移动,从而产生电流。
锌 片: Zn—2e-=Zn2+ (氧化反应) ;铜 片: 2H++2e-=H2↑ (还原反应)
总反应: Zn + 2H+ = Zn2+ + H2↑
(3)为什么正常发生的氧化还原反应一般没有电流产生,而在原电池中发生时可以产生电流呢?
【合作探究】正常发生的氧化还原反应,氧化剂和还原剂直接接触反应时,电子转移没有通过导线,而是直接转移,所以没有电流产生;在原电池中,将氧化反应和还原反应分开在两个不同区域进行,通过导线进行电子转移,电子发生定向移动,从而产生电流。
【探究结论】
原电池的工作原理:将氧化还原反应中的氧化反应和还原反应分开进行,从而使还原剂失去的电子,经导线传递给氧化剂,从而形成电流。
【探究主题】3、原电池的组成是什么?
(1)电池都有正负极,原电池的正负极如何确定?
小贴士:由物理学知识可知,电流方向是从电源的正极流向电源的负极,电子的流向与电流方向相反,从电源的负极流向电源的正极。
【合作探究】在铜和锌组成的原电池中,电子从锌电极流出,因而是原电池的负极;电子流入到铜电极,因而是原电池的正极。
【探究结论】
负极:失去电子的电极是原电池的负极,一般用活泼金属;
正极:得到电子的电极是原电池的正极,一般用不活泼金属。
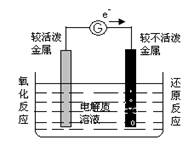
【过渡】上面我们通过实验探究了原电池的工作原理,如果想要设计一个电池就的知道原电池的组成是怎样,让我们继续探究。
(2)原电池的工作条件是什么?
【合作探究】电池要正常工作,还需要形成闭合回路,且发生氧化还原反应。
【探究结论】原电池的工作条件是:形成闭合回路;能发生氧化还原反应。
(3)原电池的组成是什么?
【合作探究】从结构来看,原电池的必须有正、负两个电极和电解质溶液以及一些辅助物(容器和导线)。由于负极在反应中提供电子,所以一般用易失去电子的活泼的金属;而在反应中正极上获得电子,因而用能导电的物质,一般是不活泼的金属;电解质溶液要保证发生氧化还原反应。
【探究结论】
【探究结论】原电池的组成:较活泼的金属做原电池的负极,较不活泼的金属做原电池的正极;有能保证发生氧化还原反应的电解质溶液。
【分享与交流】
这节课我们通过探究,学习了化学能与电能的转化,你有什么收获?请与大家分享!
1、如何将化学能直接转换为电能?
利用原电池装置可以将化学能直接转化为电能。
2、原电池的工作原理是什么?
将氧化还原反应中的氧化反应和还原反应分开进行,从而使还原剂失去的电子,经导线传递给氧化剂,从而形成电流。
3、原电池的组成是什么?
较活泼的金属做原电池的负极,较不活泼的金属做原电池的正极;能保证发生氧化还原反应的电解质溶液。
【活学活用】
根据氧化还原反应和原电池的有关知识,请同学们利用已有的实验用品,设计一套原电池装置。
主要用品: Cu片、Fe片、Al片、蔗糖溶液、硫酸铜溶液、盐酸、导线、电流表、烧杯等。
|
序号 |
正极 |
负极 |
溶 液 |
化学反应方程式 |
|
|
|
|
|
|
|
|
|
|
|
|
【课外实践活动】
根据构成原电池的条件,请同学们利用家里的橘子、苹果、柠檬或番茄等含酸的水果、铁片(或铁钉)、铜片(铜丝)等金属亲手设计制作一个成原电池,并将原电池与音乐卡片(或小电珠)连接检查是否有电流产生。
布置作业:请根据反应:2Fe3+ + Cu = 2 Fe2+ + Cu2+ 设计原电池,写出电极反应,并指出正负极材料和电解质溶液。
〖板书设计〗二、化学能直接转换为电能
1、如何将化学能直接转换为电能?
2、原电池的工作原理是什么?
3、原电池的组成是什么?
上一篇:第三节 盐类的水解
下一篇:第二节 化学能与电能(第二课时)
