对一道高考化学试题的质疑
2015-10-25 21:11:11 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
对一道高考化学试题的质疑
陕西省西安市第八十九中学 710003 董 啸
2012年全国高考理综(新课标版)第27题:光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ·mol-1、-285.8kJ·mol-1和-283.0kJ·mol-1,则生成1m3(标准状况)CO所需热量为 ;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(4)COCl2的分解反应为COCl2(g)=Cl2(g)+CO(g) △H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出):
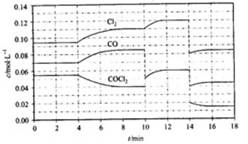
①计算反应在第8min时的平衡常数K= ;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2) T(8)(填“<”、”>”、或”=”);
③若12min时反应于温度T(8)下重新达到平衡,此时c(COCl2)= mol/L;
④比较产物CO在2-3min、5-6min和12-13min时平均反应速率[(平均反应速率分别以V(2-3)、V(5-6)、V(12-13)表示)]的大小 ;
⑤比较反应物COCl2在5-6min和15-16min时平均反应速率的大小,V(5-6) V(15-16);(填“<”、”>”或”=”),原因是 。
2012年全国高考理综(新课标版)第27题,是一道极具争议的题目,虽然该题对反应热计算和化学平衡等的考查改变过去的传统方法,让学生自主探究,全面地对考生的思维品质、归纳整合能力及应用所学知识解决实际问题的能力进行考查,体现了新课改理念,有利于培养学生的科学素养。然而,该题中存在几个不妥之处,使得该题存在致命的缺陷,特提出与大家商榷。
1.命题不严密,导致答案不唯一
该题第(2)小题中涉及到由CH4与CO2进行高温重整制备CO,该反应的条件只有高温一个,而高温是一个模糊的、不确定的条件。中学化学中经常出现反应物相同,反应条件不同,反应产物就不同的现象。根据中学化学有关知识分析,该反应可能生成CO和H2O,也可能生成CO和H2。所以,据此分析该反应的方程式可能为:CH4+CO2=2CO+2H2或CH4+3CO2=4CO+2H2O。该题要求计算生成1m3(标准状况)CO所需热量,利用盖斯定律我们不难推出以下两种结果:
①利用CH4+CO2=2CO+2H2计算
利用盖斯定律可得,该反应的热化学方程式为:
CH4(g)+CO2(g)=2H2(g)+2CO(g) ⊿H=+247.3 KJ/mol,计算可得生成1m3(标准状况)CO所需热量为5.52×103KJ;
②利用CH4+3CO2=4CO+2H2O计算
利用盖斯定律可得,该反应的热化学方程式为:
CH4(g)+3CO2(g)=4CO(g)+2H2O(l) △H=+241.7 KJ/mol,计算可得生成1m3(标准状况)CO所需热量为2.70×103KJ。
若按照题目要求分析,利用CH4与CO2进行高温重整制备1m3(标准状况)CO,所需热量为:5.52×103KJ或2.70×103KJ,而不只是参考答案所给出的5.52×103KJ。
本题命题人旨在利用燃烧热、盖斯定律和热化学方程式的计算,考查考生综合计算能力。但由于命题不严密,使得制取CO的热化学反应方程式有两个,导致答案不唯一,违背了化学基本常规。如果在命题时能多一些限定条件或已知条件,使得利用CH4与CO2制备CO的热化学反应方程式是唯一的,则可以完全避免这种情况的发生。
2.数据不易读准,条件改变不明确,容易导致误判
该题第(4)小题,要求考生利用图中的数据进行计算,但是由于图太小不易读数,导致不同考生对个别关键数据的估读结果可能不同,第①、③问的结果有较大差别。如果考生以此为依据,利用8min时各物质的物质的量浓度数据及16min时各物质的物质的量浓度数据,计算各自平衡常数进行判断,则可能导致因为读数时估读的数据有一定的差距,而使计算出的8min和16min的化学平衡常数不同,误以为温度发生了变化,并非参考答案中的温度不变,导致得出错误的结论。
另外,在研究外界条件对化学反应速率的影响时,经常使用控制变量的方法,明确指出在其他条件不变时,只改变某一个条件。但是,本题在每一个阶段条件发生变化时,并没有明确指出只改变一个条件,所以本题4min、10min、14min三次变化改变的条件是什么,是只改变一个条件还是改变几个条件,题目并没有明确说明。若只改变一个条件,还好分析,若改变多个条件则很难判断。第(4)小题第⑤问,在比较反应物COCl25-6min和15-16min时平均反应速率的大小时,标准答案指出是因为温度不变,反应物浓度越高,反应速率越大。而从题目的信息中不能准确的判断温度是否变化,也没有告诉温度不变。若温度是变化的,则无法准确分析,这样设置问题显然是不够严谨的。
3.化学用语不规范,数据繁琐,不符合中学化学教学实际
第27题第(4)小题中以光气的分解反应为背景作为化学平衡问题连续设问,化学平衡问题中涉及的化学反应均为可逆反应,但命题者给出的化学方程式中用的是“等号”,没有用“可逆符号”,这可能误导考生审题,也不符合中学化学教学实际。
另外,该题数据繁琐,数学运算量过大,导致考生在较短的时间内难于完成计算。命题者的本意是给考生提供真实的科学实验数据,而不是杜撰的数据,让学生认识到科学的严谨。然而,在考试中不允许使用计算器的情况下,让考生进行如此大量的数字计算,显然背离了高考化学考查的初衷,也背离了中学化学教学实际,毕竟这是在考查学生的化学知识和技能,而非数学计算。有些学生虽然有能力解决此题,但是由于计算量太大,稍有不慎,就会得出错误的结果,而作为填空题只看结果不要过程,这样会导致有些考生会做而做错不能得分。这和根本不会做题而没有得分结果相同,导致试题区分度不高,这显然不符合高考选拔人才的要求,也不符合新课程理念和高考的宗旨。
4.在可逆反应中比较平均速率,容易导致理解混乱
本题第(4)小题④、⑤问中,比较不同时间段的CO平均反应速率大小的设问,不太合适。因为在可逆反应中,对每一种物质都存在正反应速率和逆反应速率,正反应速率和逆反应速率是在某一时刻的即时速率,平均速率与正反应速率和逆反应速率有关,CO的平均速率是在某一时间段内CO的总物质的量浓度的变化量与时间的比值。在中学化学教学中明确指出,化学平衡是一种动态平衡,所以可逆反应达到化学平衡时,正反应速率等于逆反应速率,但不等于零。本题中可逆反应达到平衡时,CO的平均速率为零,这与正反应速率等于逆反应速率不等于零,虽然并不矛盾,但是容易引起学生理解混乱。
本题涉及到可逆反应中的平均速率和即时速率,与现行中学化学教学中的要求有一定的出入,所以在解决可逆反应中的化学平衡问题时,通常使用即时速率来分析,不宜引入平均速率。
综上所述,如果笔者认为本题命题再严谨一些,就可以避免上述问题,可使题目更加完美,更加符合中学教学实际,就能够充分发挥出试题的选拔功能,同时为新课程改革起到正确的导向作用。
联系电话:15091099026
电子信箱:15091099026@163.com
上一篇:凝心聚力 共谋发展
下一篇:在化学教学中培养学生非智力因素的探索
