高 一 化 学 试 题
2015-10-16 09:53:33 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
2012—2013学年度第一学期期末考试
高 一 化 学 试 题
注意事项:
1.答题之前,考生务必将自己的姓名、考号、座位号写在答题纸密封线内。
2.考试结束考生只交答题卡,所有答案必须填在答题卡的相应位置,写在试题上的答案无效。
可能用到的相对原子质量:H—1 O—16 N—14 C—12 C1—35.5 Na—23 Mg—24 Al—27 Fe—56 Cu—64 S—32
第I卷 (选择题 共50分)
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
1.在下列物质分类中,前者包括后者的是
A.氧化物、化合物 B.化合物、电解质
C.溶液、 胶体 D.溶液、 分散系
2.下列类型的反应,一定发生电子转移的 是
是
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
3.下列物质的用途错误的是
A、硅是制造太阳能电池的常用材料 B、硅是制取水泥的原料
C、水玻璃可用作木材防火剂 D、二氧化硅是制造光导纤维的材料
4.下列关于金属Na的叙述中,说法正确的是
A.Na在空气中燃烧,发出黄色火焰,产物是Na2O2
B.实验室中少量Na通常保存在汽油中
C.Na是银白色金属,硬度大,熔点高
D.Na与水反应时融化成小球,并有氧气生成,反应后溶液呈碱性
5.向烧杯中加入25mL蒸馏水,加热至沸腾,向沸水中逐滴加入6滴FeCl3饱和溶液。继续加热至溶液呈红棕色,停止加热,就制得了Fe(OH)3胶体。下列有关胶体的叙述不正确的是
A.胶体是一种分散系,属于混合物
B.胶体可以较长时间存在,所以胶体属于稳定体系
C.胶体粒子直径介于1nm-100nm
D.利用丁达尔现象是区分胶体和溶液的一种常用物理方法
6.由下列离子方程式改写成的化学方程式正确的是
A.Cu2++2OH-=Cu(OH)2↓:CuCO3+2NaOH=Cu(OH)2↓+Na2CO3
B.CO32-+2H+=CO2↑+H2O:BaCO3+2HCl=BaCl2+CO2↑+H2O
C.Fe+2H+=H2↑+Fe2+:Fe+2HNO3=H2↑+Fe(NO3)2
D.H++OH-=H2O:2KOH+H2SO4=K2SO4+2H2O
7.用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.标准状况下,11.2LH2O含有的分子数为0.5NA
8.镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有
A. AlO2- B.Cu2+ C.Al3+ D.Mg2+
9.能证明硅酸的酸性弱于碳酸酸性的实验事实是
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出硅酸沉淀
C.高温下SiO2与碳酸盐反应生成CO2
D.氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀
10.下列物质中既能与稀H2SO4反应, 又能与NaOH溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3
A.③④ B.①③④ C.①②③④ D.全部
11.下列离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH-=Al(OH)3↓
C.三氯化铁溶液中加入铁粉:![]()
D.FeCl2溶液Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
12.某溶液中加入KSCN溶液无明显现象,再滴加氯水,溶液立即变为红色,说明原溶液中一定含有
A.Fe3+ B.Fe2+ C.Cu2+ D.Zn2+
13.在KBr和KI混合溶液中,通入足量的氯气,反应后蒸干溶液、灼烧,残留物是
A.KCl B.KCl和KBr C.KCl和KI D.KCl、Br2和I2
14.铜粉加入稀盐酸中,加热无现象,此时向其中加入一种盐则会出现如下的现象:铜粉溶解、溶液变蓝,同时有气体放出,这种盐是
A.NaCl B.FeCl2 C.KNO3 D.Fe2(SO4)3
15.某强碱性溶液中能大量共存且溶液为无色透明的离子组是
A.![]() 、HCO3-、Na+、Cl- B.K+、Na+、SO32-、CO32-
、HCO3-、Na+、Cl- B.K+、Na+、SO32-、CO32-
C.Na+、Fe3+、SCN-、SO42- D.Al3+、Na+、Cl- 、SO42-
16.下列化学反应中,属于氧化还原反应的是( )
A、Na2CO3+CaCl2=CaCO3↓+2NaCl
B、C+2H2SO4(浓)△CO2 ↑+ 2H2O + 2SO2 ↑
C、2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
D、Na2O+H2O===2NaOH
17.在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定原溶液中含有的阳离子是
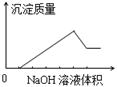
A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
18.已知反应:NaH+H2O= H2+NaOH,该反应中1mol NaH参加反应
A.失去1mol电子 B.得到1mol电子
C.失去2mol电子 D.没有电子得失
19.将Na2O2投入FeCl3溶液中,不可能观察到的现象是
A.生成白色沉淀 B.生成红褐色沉淀
C.有气泡产生 D.溶液颜色变浅
20.现有四组液体:①氯化钠溶液和四氯化碳组成的混合液 ②乙醇水溶液 ③氯化钠和单质溴的水溶液 ④碳酸钙和氯化钙溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏、蒸发 B.萃取、蒸馏、分液、过滤
C.分液、蒸馏、萃取、过滤 D.蒸馏、萃取、分液、过滤
21.提纯含有少量氯化钡杂质的氯化钾溶液,可以使用的方法为
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量盐酸
B.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量盐酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量盐酸
D.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量盐酸
22.在120℃的条件下,将体积比为1:1总质量为4.5g的CO与H2的混合气体在足量的O2中充分燃烧,然后将产生的气体通过足量的Na2O2固体中充分反应,反应后固体增加的质量为
A.4.5 g B.7.2 g C.9.3 g D.无法计算
23.2.16g X2O5中含有0.1mol 氧原子,则X的相对原子质量为
A、21.6 B、28 C、14 D、31
24.用100 mL 0.2 mol ∕ L BaCl2 溶液恰好可使相同体积的Na2SO4、Al2(SO4)3、KAl(SO4)2的溶液中的![]() 完全转化为BaSO4沉淀,需要三种盐溶液的溶质的物质的量浓度之比为
完全转化为BaSO4沉淀,需要三种盐溶液的溶质的物质的量浓度之比为
A.6:2:3 B.1:1:1 C. 2: 3:1 D.1: 3: 2
25.将38.4g铜跟适量的浓硝酸反应,铜全部作用后,共收集到气体22.4L(标况),则反应消耗的硝酸的物质的量是( )
A.1.0 mol B.1.6 mol C.2.2 mol D.2.4 mol
第Ⅱ卷 (非选择题 共50分)
二、填空题(本题包括2小题,共12分)
26.(4分)在反应3Cu+8HNO3=3Cu(NO3)2+2NO ↑+4H2O中,氧化剂是 ,氧化产物是 ,氧化剂和还原剂的物质的量之比是 ,转移的电子数为 。
27.(8分)现有11g CO2,其物质的量为 mol,其中含有O原子的个数为 个,该气体在标准状况下的体积为 L,与 gNO所含氧原子数相同。
三、推断题(共14分)
28.(6分)已知A是一种金属,B溶液能使酚酞试液变红,且焰色反应呈黄色;D、F相遇会产生白烟。A、B、C、D、E、F间有如下变化关系:
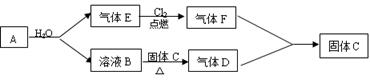
(1)B的化学式是 ;F的化学式是 。
(2)A与水反应的离子方程式为 。
(3)实验室制取D的化学方程式为 。
29.(8分)已知A为一种常见的单质,A与某溶液反应生成一种气体和化合物B,它们有以下转化关系:
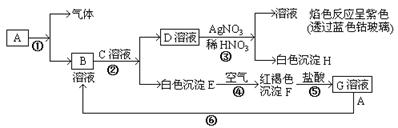
试回答: (1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出向G溶液加入A的有关离子反应方程式 。
(4)以上六个反应中属于氧化还原反应的是 。
三、实验与探究题(2小题,共18分)
30.(6分)(1) 实验室通常利用碳酸钙和盐酸反应制取CO2时,CO2中混入一种气体杂质,为了除去该杂质,可以将产生的气体通入 溶液中除去,该反应的离子方程式为 。
(2)氯气是一种有毒气体,实验室制取氯气时,为了吸收氯气,通常使用的试剂是 ,离子方程式为 。
31.(12分)(1)甲同学利用下列装置来进行铜跟浓硫酸反应实验。
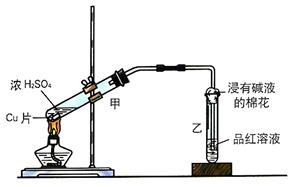
①写出甲装置中发生的主要反应的化学方程式______________________。
②乙同学认为,若要用铜制取硫酸铜,可以先用铜和氧气反应生成氧化铜,然后利用氧化铜和稀硫酸反应可以得到硫酸铜。若要制取硫酸铜,请你从环境保护和节约资源的角度分析,比较甲同学和乙同学制取硫酸铜的方法中更合理的是 ,原因是 。

(2)丙同学利用下图的方法实验室制取并验证SO2某些性质,并将实验情况记录在下表中,请完成以下表格:
|
装置序号 |
实验现象或作用 |
实验结论或化学方程式 |
|
① |
有气泡产生 |
化学方程式为:____ |
|
② |
紫色石蕊试液变 色 |
证明SO2溶于水显酸性 |
|
③ |
品红溶液褪色 |
证明SO2具有 性 |
|
④ |
溶液变浑浊 |
证明SO2具有 性 |
|
⑤ |
溴水褪色 |
证明SO2具有 性 |
|
⑥ |
吸收尾气 |
化学方程式为:____ |
五、计算题(6分)
32.将5.4g金属铝放入250mL4.0mol/LNaOH溶液中,并将反应生成的氢气收集,可以收集到氢气体积折算成标准状况多少L?若测得反应后溶液的体积仍为250mL,则NaOH的物质的量浓度是多少mol/L?
上一篇:高一化学必修2第一章单元检测
下一篇:第二节 化学计量在实验中的应用
