第十一单元 水溶液中的离子平衡(5)
2015-11-25 10:01:16 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第十一单元 水溶液中的离子平衡(5)
|
|
|
授课人:董 啸 |
|
|
①掌握原电离平衡原理、盐类水解的原理; |
|
|
教学目标: |
②掌握溶液pH与氢离子浓度、氢氧根离子浓度的简单计算; |
|
|
|
③利用平衡移动原理解释某些问题。
|
|
|
教学重点: |
液pH与氢离子浓度、氢氧根离子浓度的简单计算 |
|
|
教学难点: |
利用平衡移动原理解释某些问题 |
|
|
教学方法: |
精讲精炼,分析比较,发现规律 |
|
|
教学过程: |
第五课时 |
|
基础知识精析
五、沉淀溶解平衡
1、概念:
在一定条件下,难溶电解质溶解成离子的速率等于离子重新结合成沉淀的速率时,溶液中各离子的浓度保持不变的状态,叫做难溶电解质的溶解平衡(或沉淀的溶解平衡)。
2、表达式: 利用可逆反应的形式表示,沉淀的溶解平衡。
练习:书写碘化银、氢氧化镁溶解平衡的表达式。
3、特征:逆、等、动、定、变
4、电解质在水中的溶解度:
20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:
![]()
5、影响溶解平衡的因素:
(1)内因:电解质本身的性质
(2)外因:
①浓度:加水,平衡向溶解方向移动。
②温度:升温,多数平衡向溶解方向移动。
总结:越稀越有利于溶解;越热越有利于溶解。
以AgCl(s)≒Ag+(aq)+Cl-(aq) ΔH>0为例
|
外界条件 |
移动方向 |
平衡后c(Ag+) |
平衡后c(Cl-) |
Ksp |
|
升高温度 |
正向 |
增大 |
增大 |
增大 |
|
加水稀释 |
正向 |
减小 |
减小 |
不变 |
|
加入少量AgNO3 |
逆向 |
增大 |
减小 |
不变 |
|
通入HCl |
逆向 |
减小 |
增大 |
不变 |
|
通入H2S |
正向 |
减小 |
增大 |
不变 |
6、沉淀溶解平衡的应用
(1)沉淀的生成
①沉淀方法:
在不影响主体物质的情况下,加入某种化学试剂,使杂质离子生成沉淀,从而过滤除去。
具体方法:调节PH法;加沉淀剂法;同离子效应法;氧化还原法。
实例:
ⅰ、除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至7~8,离子方程式为Fe3++3NH3·H2O===Fe(OH)3↓+3NH。
ⅱ、用H2S沉淀Cu2+,离子方程式为H2S+Cu2+===CuS↓+2H+。
②实际应用:
物质的检验、提纯及工厂废水的处理等,生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂质或提纯物质的重要方法之一。
(2)沉淀的溶解
①溶解方法:
根据平衡移动原理分析,要使沉淀溶解,加入某些试剂,生成难电离电解质或气体,使溶解平衡向溶解的方向移动,使难溶电解质溶解的离子浓度减少。
具体做法:
ⅰ、酸溶解法:加入强酸,沉淀转化为气体,使沉淀溶解。例如,CaCO3溶于盐酸,离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑。
ⅱ、盐溶液溶解法:加入弱酸盐或弱碱盐,使沉淀转化为弱电解质或其它难溶电解质,使沉淀溶解。例如,Mg(OH)2溶于NH4Cl溶液,离子方程式为Mg(OH)2+2NH===Mg2++2NH3·H2O。
ⅲ、氧化还原溶解法:加入氧化剂或还原剂,利用氧化还原反应,使某些离子浓度减小。适用于具有明显氧化性或还原性的难溶物,例如不溶于盐酸的硫化物Ag2S溶于稀HNO3。(![]() )。
)。
ⅳ、配位溶解法:加入某些特殊试剂,使沉淀转化为溶液。例如AgCl溶于氨水,例如,AgCl加氨水生成银氨离子可溶解,离子方程式为AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O;硫酸铅加入醋酸,可以使沉淀溶解。
②应用:常用于除去残留物或分离固体物质。
(3)沉淀的转化
①沉淀转化方法:
沉淀转化的方法是加入可与体系中某些离子反应的物质,生成更难溶电解质。
依据:利用溶解度或溶度积常数比较,选择溶解度更小的沉淀的离子,作为沉淀转化试剂。
【思考】当向AgNO3和NaCl恰好完全反应的平衡体系中加入I-,会看到什么现象?若再加入S2-,会看到什么现象?
②沉淀转化特点:
a.沉淀转化的实质是沉淀溶解平衡的移动。
b.溶解度小的沉淀,转化为溶解度更小的沉淀。
c.溶解度差异越大,转化越容易。
③应用:
在工业生产实际中,对于有些沉淀用酸或其他方法也不能溶解沉淀。可以先将其转化为另一种可以用酸或其他方法能溶解的沉淀。
【归纳】沉淀的生成、溶解、转化本质上都是沉淀溶解平衡的移动问题,其基本依据主要有:
①加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子,使平衡向溶解的方向移动。
②温度:升温,多数平衡向溶解方向移动。
③加入相同离子,平衡向沉淀方向移动。
![]() 深度思考
深度思考![]()
1.沉淀的溶解平衡是怎样建立的?勒夏特列原理是否适用于该平衡?
答案:难溶电解质的溶解度虽然很小,但不可能为零(完全不溶解),溶液中的离子结合成难溶电解质时,也不可能完全进行到底。故难溶电解质在水中会建立如下平衡:MmAn(s)溶解沉淀mMn+(aq)+nAm-(aq)。勒夏特列原理同样适用于沉淀溶解平衡。
2.难溶的氯化银在水中也存在着溶解平衡AgCl(s)=Ag+(aq)+Cl-(aq),怎样用实验证明溶液中可以同时存在着少量的Ag+和Cl-?
答案 取适量的AgCl溶解于试管中,滴加酸化的AgNO3溶液,生成白色沉淀,证明溶液中含Cl-,另取适量AgCl溶解于试管中,滴加Na2S溶液,生成黑色沉淀,证明溶液中含Ag+。
3.(1)0.1 mol·L-1的盐酸与0.1 mol·L-1的AgNO3溶液等体积混合完全反应后溶液中含有的微粒有____________。
(2)下列方程式①AgCl(s)=Ag+(aq)+Cl-(aq)、
②AgCl===Ag++Cl-、 ③CH3COOH=CH3COO-+H+各表示什么意义?
答案 (1)H2O、H+、OH-、Ag+、Cl-、NO、AgCl
(2)①AgCl的溶解平衡;②AgCl是强电解质,溶于水的AgCl完全电离;③CH3COOH的电离平衡。
4.(1)在实验室中怎样除去NaCl溶液中的BaCl2?
(2)怎样除去AgI中的AgCl?
答案 (1)向溶液中加入过量的Na2CO3溶液充分反应过滤,向滤液中加适量盐酸。
(2)把混合物与饱和KI溶液混合,振荡静置,溶度积大的AgCl就慢慢转化为溶度积小的AgI。
5.试用平衡移动原理解释下列事实:
(1)BaCO3不溶于水,为什么不能作钡餐?
(2)CaCO3难溶于稀H2SO4,却能溶于醋酸中;
(3)分别用等体积的蒸馏水和0.01 mol·L-1的盐酸洗涤AgCl沉淀,用水洗涤造成的AgCl的损失大于用稀盐酸洗涤的损失量。
答案 (1)BaCO3(s)Ba2+(aq)+CO(aq),HCl===H++Cl-,2H++CO===H2O+CO2↑,盐酸电离的H+与BaCO3产生的CO结合生成CO2和H2O,破坏了BaCO3的溶解平衡,c(Ba2+)增大,引起人体中毒。
(2)CaCO3(s)=Ca2+(aq)+CO(aq),H2SO4===SO+2H+,因为生成的CaSO4溶解度较小,会附在CaCO3的表面,阻止平衡的右移。而CH3COOH=CH3COO-+H+生成的醋酸钙易溶于水;当H+与CO结合生成CO2和H2O时,CaCO3的溶解平衡右移。
(3)用水洗涤AgCl,AgCl(s)=Ag+(aq)+Cl-(aq)平衡右移,AgCl的质量减少,用HCl洗涤AgCl,稀释的同时HCl电离产生的Cl-会使平衡左移,AgCl减少的质量要小些。
6、溶度积(平衡常数)——Ksp
对于沉淀MmAn存在溶解平衡: MmAn (s)![]() mMn+(aq)+ nAm-(aq)沉淀溶解平衡的平衡常数:Ksp=[c(Mn+) ]m·[c(Am— )]n
mMn+(aq)+ nAm-(aq)沉淀溶解平衡的平衡常数:Ksp=[c(Mn+) ]m·[c(Am— )]n
说明:固体物质浓度可以看做不变,不列入平衡常数。
(1)定义:在一定温度下,沉淀达到溶解平衡时,溶液中的离子浓度幂的乘积是一个常数,叫做沉淀的溶解平衡常数,也称为溶度积常数,简称溶度积。符号为:Ksp
说明:①Ksp只与温度有关,绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向溶解方向移动,Ksp增大,但Ca(OH)2相反。
②对于溶解平衡:AmBn(s)=mAn+(aq)+nBm-(aq),Ksp=cm(An+)·cn(Bm-),对于相同类型的物质,Ksp的大小,反映了难溶电解质在溶液中溶解能力的大小,也反映了该物质在溶液中沉淀的难易。
(2)意义:
溶度积的大小反映了难溶电解质在水中的溶解能力。溶度积越大,越易溶解,溶度积越小,越难溶解。
(3)应用:判断难溶电解质的溶解情况。
判断方法:对于任意一种难溶电解质,通过对比溶度积和离子积(有关离子浓度幂的乘积称为离子积,符号为Qc)的相对大小,可以判断难溶电解质的溶解情况。
若任意时刻有:Qc = [ c (Mn+) ]m·[c(Am— )]n 则有:
Qc>Ksp:溶液过饱和,继续析出沉淀,直至溶液饱和(Qc=Ksp),达到新的溶解平衡。
Qc=Ksp:溶液饱和,溶解平衡状态,沉淀量不变。
Qc<Ksp:溶液未饱和,无沉淀析出,若加入电解质,则可以继续溶解,直至达到新的溶解平衡。
说明:以上规则称为溶度积规则。根据溶度积规则,要使沉淀溶解,可以加入某种试剂,使其与难溶电解质电离出来的离子作用,控制离子浓度的大小,从而降低该离子的浓度,使Qc<Ksp,平衡向沉淀溶解的方向移动。
(4)溶解平衡曲线:
若将达到溶解平衡时,溶液中各种离子浓度的浓度绘制成曲线,就是溶解平衡曲线。
例如:氯化银的溶解平衡曲线为:
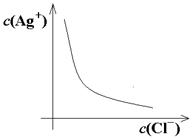
含义:在曲线上的每个点达到溶解平衡;在曲线左侧和下侧的点,Qc﹤Ksp,未达到溶解平衡,可以继续溶解;在曲线左侧和下侧的点,Qc﹤Ksp,未达到溶解平衡,可以继续溶解;在曲线右侧和上侧的点,Qc﹥Ksp,达到溶解平衡,将继续沉淀。
经验规律:对于同类型的难溶电解质来说,Ksp越大,溶解度越大,Ksp越小,溶解度越小。
(5)计算:
例1:25℃时, Ksp(AgBr)= 5.0×10-10,求AgBr的饱和溶液中的[Ag+]和[Br-]。
练习:25℃时,Ksp(Mg(OH)2)= 5.6×10-12,求Mg(OH)2 的饱和溶液中的[Mg2+]和[OH-]。
例2:在室温下,BaSO4的溶度积为1.07×10-10,计算每升饱和溶液中所溶解BaSO4为多少克?
解:设浓度为xmol/L.
BaSO4 ![]() Ba2+ + SO42- x=
Ba2+ + SO42- x=![]() =1.03×10-5 (mol·L-1)
=1.03×10-5 (mol·L-1)
MBaSO4=233g/mol,每L饱和溶液中所溶解BaSO4的质量为:
1.03×10-5×233=2.40×10-3(g)
练习:25℃时Ksp (AgIO3)= 3.1×10-8 、 Ksp (Ag2CrO3)= 1.1×10-12 ,比较AgIO3、 Ag2CrO3的饱和溶液中溶解度的大小。
![]() 深度思考
深度思考![]()
1.AgCl的Ksp=1.80×10-10,将0.002 mol·L-1的NaCl和0.002 mol·L-1的AgNO3溶液等体积混合,是否有AgCl沉淀生成?
答案 c(Cl-)·c(Ag+)=0.001×0.001=10-6>Ksp,有沉淀生成。
2.利用生成沉淀的方法能否全部除去要沉淀的离子?
答案 不可能将要除去的离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已经完全。
3.下列有关溶度积常数Ksp的说法正确的是 ( )
A.常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小
B.溶度积常数Ksp只受温度影响,温度升高Ksp减小
C.溶度积常数Ksp只受温度影响,温度升高Ksp增大
D.常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变
答案 D
解析 温度不变,溶度积常数不变,故A项不正确;大多数的难溶物温度升高,Ksp增大,但也有少数物质相反,故B、C均不正确。
【探究高考】
1.(2009·广东,18改编)硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下。下列说法正确的是 ( )

A.温度一定时,Ksp(SrSO4)随c(SO)的增大而减小
B.三个不同温度中,313 K时Ksp(SrSO4)最大
C.283 K时,图中a点对应的溶液是饱和溶液
D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
答案 B
解析 温度一定,Ksp(SrSO4)不变,A错误;由题中沉淀溶解平衡曲线可看出,313 K时,c(Sr2+)、c(SO)最大,Ksp最大,B正确;a点c(Sr2+)小于平衡时c(Sr2+),故未达到饱和,沉淀继续溶解,C不正确;从283 K升温到363 K要析出固体,依然为饱和溶液。
2.(2011·浙江理综,13)海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
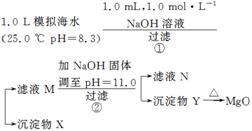
|
模拟海水中的离子浓度/mol·L-1 |
Na+ |
Mg2+ |
Ca2+ |
Cl- |
HCO |
|
0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;
实验过程中,假设溶液体积不变。
Ksp(CaCO3)=4.96×10-9 Ksp(MgCO3)=6.82×10-6
Ksp[Ca(OH)2]=4.68×10-6 Ksp[Mg(OH)2]=5.61×10-12
下列说法正确的是 ( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
答案 A
解析 由于HCO+OH-+Ca2+===CaCO3↓+H2O反应存在,且Ksp(CaCO3)=4.96×10-9,又可求得c(CO)·c(Ca2+)=1.0×10-3 mol·L-1×1.1×10-2
mol·L-1>Ksp(CaCO3),因此X为CaCO3,A正确;Ca2+反应完后剩余浓度大于1.0×
10-5 mol·L-1,则滤液M中存在Mg2+、Ca2+,B不正确;pH=11.0时可求得c(OH-)=10-3 mol·L-1,Ksp[Mg(OH)2]=5.61×10-12,c(Mg2+)=<1.0×10-5,因此N中只存在Ca2+不存在Mg2+,C不正确;加入4.2 g NaOH固体时沉淀物应是Mg(OH)2,D错误。
3.(2010·山东理综,15)某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离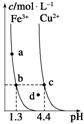 子浓度的变化如图所示。据图分析,下列判断错误的是 ( )
子浓度的变化如图所示。据图分析,下列判断错误的是 ( )
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
答案 B
解析 根据题意,图中曲线为沉淀溶解平衡曲线,曲线上的所有点对应的溶液都是达到沉淀溶解平衡的溶液,D正确;选取曲线上的b、c两点,当溶液中两种阳离子浓度相同时,Fe(OH)3饱和溶液中的OH-浓度小于Cu(OH)2饱和溶液中的OH-浓度,所以Ksp[Fe(OH)3]<Ksp[Cu(OH)2],A正确;向Fe(OH)3饱和溶液中加入NH4Cl固体,促进了氢氧化铁的溶解,溶液中铁离子浓度增大,B错误;由于一定温度下的水溶液中,水的离子积是一个常数,所以c、d两点代表的溶液中c(H+)与c(OH-)乘积相等,C正确。
4.[2009·山东理综,28(3)]在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式为________。
已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
答案 Cu(OH)2 Cu2++2NH3·H2O===Cu(OH)2 ↓+2NH
解析 因为Ksp[Cu(OH)2]<Ksp[Mg(OH)2],所以先生成Cu(OH)2沉淀。
5.(1)(2012·浙江理综,12D改编)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:________。答案 ④>①>②>③
(2)[2012·浙江理综,26(1)]已知:I2+2S2O===S4O+2I-
相关物质的溶度积常数见下表:
|
物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
|
Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入_____,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_______。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
答案 Cu(OH)2[或Cu2(OH)2CO3或CuO或CuCO3]
2.6×10-9 mol·L-1
解析 Fe(OH)3、Cu(OH)2的Ksp分别为2.6×10-39、2.2×10-20,则Fe3+、Cu2+开始产生沉淀时c(OH-)分别为2.97×10-10 mol·L-1、3.53×10-7 mol·L-1。除去酸性CuCl2溶液中的少量FeCl3,可加入Cu(OH)2或Cu2(OH)2CO3或CuO或CuCO3调节溶液的pH,使Fe3+先转化为沉淀析出。pH=4时,c(H+)=10-4 mol·L-1,则c(OH-)= mol·L-1=1×10-10 mol·L-1,此时c(Fe3+)== mol·L-1=2.6×10-9 mol·L-1。
6.[2011·福建理综,24(3)]已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K=________。
答案 2.79×103
解析 根据氢氧化铁的平衡常数表达式:Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-),而该反应的平衡常数K的表达式为K=c(Fe3+)/c3(H+),又由于25 ℃时水的离子积为Kw=1×10-14,从而推得K=Ksp[Fe(OH)3]/(Kw)3,即K=2.79×10-39/(1×10-14)3=2.79×103。
高考考点透析
一、考纲要求
(1)理解电解质的电离平衡概念。
(2)了解水的电离、溶液pH等概念。
(3)了解强酸强碱中和滴定的原理。
(4)理解盐类水解的原理。了解盐溶液的酸碱性。
二、考点透析
考试热点
1.判断强弱电解质,比较其导电性的强弱;比较溶液中离子浓度大小;
2.外界条件对电离平衡的影响,依据平衡移动原理解释某些问题;
3.水的电离平衡和离子积的应用;酸、碱溶液及其混合液涉及pH的分析判断、比较及计算。
〖教后记〗
题组一 沉淀溶解平衡及其影响因素
1.有关AgCl的沉淀溶解平衡的说法正确的是 ( )
A.AgCl沉淀生成和溶解同时在不断进行,且速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.只要向含有AgCl的饱和溶液中加入盐酸,一定会有沉淀生成
D.向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化
答案 A
解析 A项,沉淀溶解平衡是一个动态平衡,正确;B项,沉淀溶解平衡存在,则肯定存在Ag+和Cl-,故不正确;C项,如果加入盐酸后溶液中Cl-的浓度小于原饱和溶液中的Cl-浓度,则不产生沉淀;D项,向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀会转变为AgBr沉淀。
2.已知溶液中存在平衡:
Ca(OH)2(s)Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是
( )
①升高温度,平衡逆向移动
②向溶液中加入少量碳酸钠粉末能增大钙离子浓度
③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液
④恒温下向溶液中加入CaO,溶液的pH升高
⑤给溶液加热,溶液的pH升高
⑥向溶液中加入Na2CO3溶液,其中固体质量增加
⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
A.①⑥ B.①⑥⑦
C.②③④⑥ D.①②⑥⑦
答案 A
解析 ②会生成CaCO3,使Ca2+浓度减小,错误;加入氢氧化钠溶液会使平衡左移,有Ca(OH)2沉淀生成,但Ca(OH)2的溶度积较大,要除去Ca2+,应把Ca2+转化为更难溶的CaCO3,③错误;恒温下Ksp不变,加入CaO后,溶液仍为Ca(OH)2的饱和溶液,pH不变,④错;加热,Ca(OH)2的溶解度减小,溶液的pH降低,⑤错;加入Na2CO3溶液,沉淀溶解平衡向右移动,Ca(OH)2固体转化为CaCO3固体,固体质量增加,⑥正确;加入NaOH固体平衡向左移动,Ca(OH)2固体质量增加,⑦错。
3.下列叙述不正确的是 ( )
A.CaCO3能够溶解在CO2的水溶液中
B.Mg(OH)2可溶于盐酸,不溶于NH4Cl溶液
C.AgCl可溶于氨水
D.MgSO4溶液中滴加Ba(OH)2得到两种沉淀
答案 B
解析 沉淀溶解平衡体系中的离子被消耗可促进沉淀的溶解,增大某种离子浓度可以促进沉淀生成。A项中CaCO3(s)Ca2+(aq)+CO(aq),H2CO3H++HCO,CO和H+结合生成HCO,促使两个平衡都向右移动,CaCO3逐渐溶解转化为Ca(HCO3)2;B项中Mg(OH)2(s)Mg2+(aq)+2OH-(aq),加入盐酸或NH4Cl溶液,均消耗OH-,促使Mg(OH)2溶解;C项中AgCl(s)Ag+(aq)+Cl-(aq),加入氨水后Ag++2NH3·H2O[Ag(NH3)2]++2H2O,所以AgCl逐渐溶解;D项中反应的离子方程式为Mg2++SO+Ba2++2OH-===Mg(OH)2↓+BaSO4↓,得到两种沉淀。
题组二 沉淀溶解平衡在工农业生产中的应用
(一)废水处理
4.水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是__________(填字母编号,可多选)。
|
选项 |
污染物 |
处理措施 |
方法类别 |
|
A |
废酸 |
加生石灰中和 |
物理法 |
|
B |
Cu2+等重金属离子 |
加硫化物沉降 |
化学法 |
|
C |
含纯碱的废水 |
加石灰水反应 |
化学法 |
(2)下图是某市污水处理的工艺流程示意图:
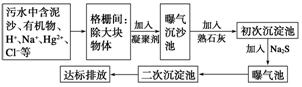
①下列物质中不可以作为混凝剂(沉降剂)使用的是______(填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝
C.碱式氯化铝 D.氯化铁
②混凝剂除去悬浮物质的过程是________(填字母编号)。
A.物理变化 B.化学变化
C既有物理变化又有化学变化
(3)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:KCN+2KOH+Cl2===KOCN+2KCl+H2O再投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式:
KOCN+KOH+Cl2―→CO2+N2+KCl+H2O。若处理上述废水20 L,使KCN完全转化为无毒物质,至少需液氯__________g。
答案 (1)BC (2)①B ②C
(3)2 4 3 2 1 6 2 35.5
解析 (1)工业废水中的废酸可加生石灰中和,属于化学变化。CuS、HgS、Ag2S均难溶,所以加硫化物如Na2S可沉淀Cu2+等重金属离子,消除污染;纯碱可加入石灰水生成CaCO3沉淀而除去。
(2)偏铝酸钠、碱式氯化铝、氯化铁水解生成胶体,除去悬浮物,而Al2O3难溶于水,不能产生胶体,不能作混凝剂。在除去悬浮物的过程中既有物理变化又有化学变化。
(3)根据KCN+2KOH+Cl2===KOCN+2KCl+H2O、2KOCN+4KOH+3Cl2===2CO2+N2+6KCl+2H2O,n(KCN)==0.2 mol,
n(Cl2)=0.2 mol+×3=0.5 mol,
所以m(Cl2)=0.5 mol×71 g·mol-1=35.5 g。
(二)废物利用
5.硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
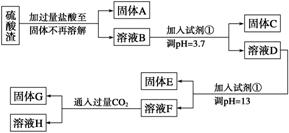
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3 mol·L-1。请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式:____________________________。
(2)上述流程中两次使用试剂①,推测试剂①应该是________(填以下字母编号)。
A.氢氧化钠 B.氧化铝
C.氨水 D.水
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________________(任写一点)。
(4)H中溶质的化学式:______________。
(5)计算溶液F中c(Mg2+)=________(25 ℃时,氢氧化镁的Ksp=5.6×10-12)。
答案 (1)SiO2+2NaOH===Na2SiO3+H2O
(2)A
(3)镁离子沉淀不完全或氢氧化铝溶解不完全等
(4)NaHCO3
(5)5.6×10-10 mol·L-1
解析 固体A为SiO2,SiO2+2NaOH===Na2SiO3+H2O,一水合氨饱和溶液中
c(OH-)=1×10-3 mol·L-1,达不到0.1 mol·L-1,所以应加NaOH溶液调节pH值。
在溶液中含有Fe3+、Al3+、Mg2+、Cl-,通过加入NaOH,调节pH值,分别使
Fe3+、Mg2+沉淀,使Al(OH)3溶解。根据信息,调节pH=3.7时,使Fe3+完全沉淀,调节pH=13时,使Mg2+沉淀,使Al(OH)3溶解。若pH过小,会造成镁离子沉淀不完全或Al(OH)3溶解不彻底。溶液F为NaAlO2溶液,通入足量CO2后,生成Al(OH)3沉淀和NaHCO3溶液。(5)c(Mg2+)===5.6×10-10 mol·L-1。
题组一 溶度积的有关计算及应用
1.在25 ℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×
10-24。下列有关说法中正确的是 ( )
A.25 ℃时,CuS的溶解度大于ZnS的溶解度
B.25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀
生成
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
答案 D
解析 1 L溶液中溶解的CuS的质量为×10-18×96 g,同理1 L溶液中溶解的ZnS的质量为×10-12×97 g,所以CuS的溶解度小于ZnS的溶解度,A、B错误;FeS的Ksp大于ZnS,所以C选项应只有ZnS生成;D选项依据沉淀的转化,溶度积大的FeS可以转化为溶度积小的CuS。
2.(1)已知Ksp(AgCl)=1.8×10-10,则将AgCl放在蒸馏水中形成饱和溶液,溶液中的c(Ag+)是多少?
(2)已知Ksp[Mg(OH)2]=1.8×10-11,则将Mg(OH)2放入蒸馏水中形成饱和溶液,溶液的pH为多少?
(3)在0.01 mol·L-1的MgCl2溶液中,逐滴加入NaOH溶液,刚好出现沉淀时,溶液的pH是多少?当Mg2+完全沉淀时,溶液的pH为多少?
答案 (1)由AgCl(s)Ag+(aq)+Cl-(aq)
知c(Ag+)=c(Cl-)
所以Ksp(AgCl)=1.8×10-10=c(Ag+)·c(Cl-)=c2(Ag+)
解得c(Ag+)=1.3×10-5mol·L-1
(2)由Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
知Ksp[Mg(OH)2]=1.8×10-11=c(Mg2+)·c2(OH-)=·c2(OH-)
解得c(OH-)=3.3×10-4mol·L-1
所以c(H+)==3.0×10-11mol·L-1
所以pH=10.5
(3)由Ksp[Mg(OH)2]=1.8×10-11=c(Mg2+)·c2(OH-)=0.01·c2(OH-)
c(OH-)=4.2×10-5mol·L-1
c(H+)==2.4×10-10mol·L-1
所以pH=9.6,即当pH=9.6时,开始出现Mg(OH)2沉淀。
由于一般认为残留在溶液中的离子浓度小于1×10-5mol·L-1时,沉淀已经完全。故Mg2+完全沉淀时有:
1×10-5·c2(OH-)=1.8×10-11
所以c(OH-)=1.34×10-3mol·L-1
c(H+)==7.46×10-12 mol·L-1
所以pH=11.1
3.已知Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,现在向0.001 mol·L-1 K2CrO4和0.01 mol·L-1 KCl混合液中滴加0.01 mol·L-1 AgNO3溶液,通过计算回答:
(1)Cl-、CrO谁先沉淀?
(2)刚出现Ag2CrO4沉淀时,溶液中Cl-浓度是多少?(设混合溶液在反应中体积不变)
答案 (1)Cl-先沉淀 (2)4.13×10-6 mol·L-1
解析 由Ksp(AgCl)=c(Ag+)·c(Cl-)得c(Ag+)== mol·L-1=1.8×10-8 mol·L-1。
由Ksp(Ag2CrO4)=c2(Ag+)·c(CrO),得c(Ag+)==mol·L-1=4.36×10-5mol·L-1,生成AgCl沉淀需c(Ag+)小于生成Ag2CrO4沉淀时所需c(Ag+),故Cl-先沉淀。刚开始生成Ag2CrO4沉淀时,c(Cl-)==mol·L-1=4.13×10-6 mol·L-1。
题组二 溶度积与溶解平衡曲线
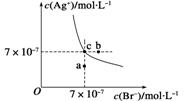 4.在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图
4.在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图
所示。又知t ℃时AgCl的Ksp=4×10-10,下列说
法不正确的是 ( )
A.在t ℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)的平衡常数K≈816
答案 B
解析 根据图中c点的c(Ag+)和c(Br-)可得该温度下AgBr的Ksp为4.9×10-13,A正确。在AgBr饱和溶液中加入NaBr固体后,c(Br-)增大,溶解平衡逆向移动,
c(Ag+)减小,故B错。在a点时Qc<Ksp,故为AgBr的不饱和溶液,C正确。选项D中K=c(Cl-)/c(Br-)=Ksp(AgCl)/Ksp(AgBr),代入数据得K≈816,D正确。
5.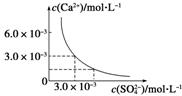 已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图
已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图
所示,向100 mL该条件下的CaSO4饱和溶液中加
入400 mL 0.01 mol·L-1 Na2SO4溶液,下列叙述正确
的是 ( )
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO)都变小
C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO)比原来的大
答案 D
解析 本题是一道考查沉淀溶解平衡的图像题。由题意知,Ksp(CaSO4)=
c(Ca2+)·c(SO)=3.0×10-3×3.0×10-3=9×10-6,CaSO4饱和溶液中c(Ca2+)=c(SO)=3.0×10-3 mol·L-1。加入400 mL 0.01 mol·L-1 Na2SO4溶液后,c(Ca2+)==6×10-4 (mol·L-1),c(SO)==8.6×
10-3(mol·L-1),Qc=c(Ca2+)·c(SO)=6×10-4×8.6×10-3=5.16×10-6<Ksp,所以没有沉淀(CaSO4固体)析出,但溶液中c(SO)变大了,c(Ca2+)变小了,故只有D项正确。
相关热词搜索:
上一篇:第10单元 电化学基础1(原电池).ppt
下一篇:第十二单元 有机化学基础(5)
