第十单元 电化学基础(4)
2015-11-25 09:36:51 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第十单元 电化学基础(4)
|
|
|
授课人:董 啸 |
|
|
①理解原电池原理。初步了解化学电源。 |
|
|
教学目标: |
②理解电解原理。了解铜的电解精炼、镀铜、氯碱工业反应原理。 |
|
|
|
③原电池和电解池电极判断以及电极方程式书写。
|
|
|
教学重点: |
原电池原理、理解电解原理、电极方程式书写 |
|
|
教学难点: |
原电池和电解池电极判断以及电极方程式书写 |
|
|
教学方法: |
分析比较法 |
|
|
教学过程: |
第四课时 |
|
基础知识精析
三、金属的腐蚀与防护
1、金属腐蚀的分类
①化学腐蚀:直接由化学反应引起的腐蚀
②电化腐蚀:由于原电池反应引起的腐蚀,包括析氢腐蚀和吸氧腐蚀两种。
a. 析氢腐蚀:酸性条件
负极:Fe-2e-=Fe2+ 正极:2H++2e-=H2
总反应:Fe+2H+=Fe2+ H2
b. 吸氧腐蚀:中性或碱性条件
负极:Fe-2e-=Fe2+ 正极:O2+2H2O+4e-=4OH-
总反应:Fe+O2+2H2O=Fe(OH)2
电解引起的腐蚀>原电池引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀。
2、金属的防护
金属的防护的基本思路是防止金属形成原电池,发生原电池反应。
(1)阻断原电池法
由于钢铁腐蚀主要是形成原电池而被腐蚀的,所以也可以让它不形成原电池,从而得到保护。
①覆盖保护膜法:
在钢铁表面覆盖一层保护膜(涂油漆,电镀,钝化等),从而阻断它和外界环境的接触,这样就会因为没有电解质溶液,而不能形成原电池。
②改变金属的内部结构法:
在钢铁中加入一定量的镍和铬,由于镍和铬在空气中容易氧化生成致密的保护膜,从而阻止内部金属与外界接触。从而把普通钢变成不锈钢。这个原理和镁铝自身防腐的原理相似。
(2)牺牲阳极的阴极保护法:
利用原电池原理,在被保护的钢铁金属设备上,装上若干锌块。由于锌比铁活泼,当它们在潮湿或有水的环境中形成原电池时,腐蚀(牺牲)的是镁或锌(阳极),而阴极的铁得到保护,所以,这种防腐方法称为牺牲阳极的阴极保护法。这种防腐方法要定期更换锌块,可以保证钢铁金属设备不被腐蚀。
(3)外加电源的阴极保护法:
利用电解原理,在被保护的钢铁金属设备上连接直流电源,把被保护的钢铁金属设备作为阴极,用惰性电极作为辅助阳极。装上若干镁合金或锌块。当钢铁设备接触电解质溶液(海水)时,接通电源,电子强制流向被保护的钢铁设备(阴极),使其无法失去电子,而得到保护,所以这种防腐方法称为外加电源的阴极保护法。
![]() 深度思考
深度思考![]()
1.下列有关金属腐蚀的叙述正确的是 ( )
A.金属越纯越不易被腐蚀
B.干燥环境下金属不被腐蚀
C.铜一定比铁难腐蚀
D.金属腐蚀有化学腐蚀和电化学腐蚀
答案 D
解析 A项,金属能不能被腐蚀主要取决于它的活泼性,而不是它的纯度,如纯钾易被腐蚀,不正确;B项,干燥环境下,如果遇到氯气,金属也可以发生化学腐蚀,故不正确;C项,如果遇到浓硝酸,铜比铁易腐蚀,不正确。
2.下列对几种常见的金属防腐方法的描述错误的是 ( )
|
选项 |
方法 |
对相应方法的描述 |
|
A |
改变金属内部的组成结构 |
此法实际上是将金属制成合金,增强抗腐蚀能力 |
|
B |
在金属表面覆盖保护层 |
保护层破损后,就完全失去了对金属的保护作用 |
|
C |
外加电流的阴极保护法 |
接外加直流电源构成电解池,被保护的金属作阴极 |
|
D |
牺牲阳极的阴极保护法 |
构成原电池,被保护的金属作正极 |
答案 B
解析 如果镀层金属比被保护的金属活泼,破损后可构成原电池,仍然能在一定程度上保护金属,B错误。
考纲要求
(1)理解原电池原理。初步了解化学电源。了解化学腐蚀与电化学腐蚀及一般防腐蚀方法。
(2)理解电解原理。了解铜的电解精炼、镀铜、氯碱工业反应原理。
(3)原电池和电解池电极判断以及电极方程式书写。
(4)原电池和电解池的简单计算。
【探究高考】
1.(2012·山东理综,13)下列与金属腐蚀有关的说法正确的是 ( )
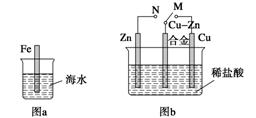
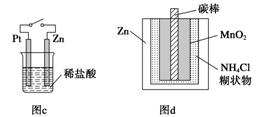
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,CuZn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,ZnMnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
答案 B
解析 A项,插入海水中的铁棒靠近液面的位置与氧气接触,易发生吸氧腐蚀;B项,开关由M改置于N时,Zn作负极,CuZn合金作正极,合金受到保护;C项,接通开关形成原电池,Zn作负极,Zn的腐蚀速率增大,但气体是在Pt电极上生成;D项,ZnMnO2干电池自放电腐蚀主要是Zn发生氧化反应而自放电。
2.(2012·海南,10)下列叙述错误的是 ( )
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.铁管上镶嵌锌块,铁管不易被腐蚀
答案 C
解析 选项A,生铁中的碳和铁可以在铁的表面构成无数微小的原电池,能加速铁的锈蚀;选项B,焊接处铁、锡形成无数微小原电池,加速铁的腐蚀;选项C,电镀时,镀层金属铜作阳极,铁制品作阴极,用铜盐溶液作电镀液;选项D,由于Zn比Fe活泼,故镶嵌锌块的铁管不易被腐蚀。
3.(2012·上海,14)右图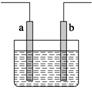 装置中发生反应的离子方程式为Zn+2H+―→Zn2++H2↑,下列说法错误的是 ( )
装置中发生反应的离子方程式为Zn+2H+―→Zn2++H2↑,下列说法错误的是 ( )
A.a、b不可能是同种材料的电极
B.该装置可能是电解池,电解质溶液为稀盐酸
C.该装置可能是原电池,电解质溶液为稀盐酸
D.该装置可看作是铜-锌原电池,电解质溶液是稀硫酸
答案 A
解析 若该装置为电解池,则a、b两电极的材料可以都为Zn,选项A错误;在保证阳极为Zn时,该电解池的电解质溶液可以为稀盐酸,选项B正确;在保证其中一电极的材料为Zn,另一电极的材料的活动性比Zn弱的情况下,该原电池的电解质溶液为稀盐酸或稀硫酸都可以,选项C、D正确。
4.(2012·浙江理综,10)以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
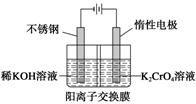
下列说法不正确的是 ( )
A.在阴极室,发生的电极反应为2H2O+2e-===2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO+2H+=Cr2O+H2O向右移动
C.该制备过程中总反应的化学方程式为4K2CrO4+4H2O2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为1-
答案 D
解析 本题应结合电解的原理来具体分析、解决问题。
根据阴、阳离子的放电顺序可知,该电解池中的反应如下:
阴极:4H2O+4e-===2H2↑+4OH-、阳极:2H2O-4e-===O2↑+4H+,阳极区K2CrO4溶液中存在平衡:2CrO+2H+=Cr2O+H2O,H+浓度增大,使该平衡右移生成Cr2O。故电解池中的总反应式可写成4K2CrO4+4H2O2K2Cr2O7+4KOH+2H2↑+O2↑。故A、B、C项均正确。
D项,设K2CrO4转化为K2Cr2O7的转化率为α,则:
2K2CrO4~K2Cr2O7
初始量 2 0
转化量 2α α
最终量 2-2α α
则有==d
解得α=2-d,D项错误。
5.(2012·安徽理综,11)某兴趣小组设计如下微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转。
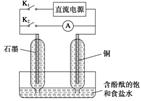
下列有关描述正确的是 ( )
A.断开K2,闭合K1时,总反应的离子方程式为
2H++2Cl-Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应式为Cl2+2e-===2Cl-
D.断开K1,闭合K2时,石墨电极作正极
答案 D
解析 解答本题时应特别注意,金属Cu在电解池和原电池中作何种电极。当断开K2,闭合K1时为电解池,由于两极都有气泡冒出,故相当于惰性电极电解饱和食盐水,故铜作阴极而石墨作阳极,阳极反应为2Cl--2e-===Cl2↑,电池总反应的离子方程式为2Cl-+2H2OH2↑+Cl2↑+2OH-,A、B都错;当断开K1,闭合K2时组成原电池,铜作负极而石墨作正极,铜电极的电极反应式为Cu-2e-===Cu2+,故C错而D正确。
6.[2012·重庆理综,29(3)]人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如下图。
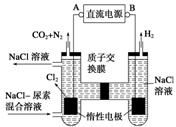
①电源的负极为________(填“A”或“B”)。
②阳极室中发生的反应依次为____________、__________。
③电解结束后,阴极室溶液的pH与电解前相比将________;若两极共收集到气体13.44 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
答案 ①B ②2Cl--2e-===Cl2↑ CO(NH2)2+3Cl2+H2O===N2+CO2+6HCl ③不变 7.2
解析 ①由图中产生Cl2极为阳极知A为正极,B为负极。
②阳极室发生反应2Cl--2e-===Cl2↑。
由产物CO2、N2知CO(NH2)2在此室反应被氧化,CO(NH2)2―→CO2+N2,发生还原反应的为Cl2。故方程式为CO(NH2)2+3Cl2+H2O===N2+CO2+6HCl。
③阴极室2H++2e-===H2↑。阳极室产生的H+通过质子交换膜进入阴极室,从而使阴极室H+浓度保持不变。pH与电解前相比不变。
两极共收集到的气体n(气体)==0.6 mol
 m[CO(NH2)2]==7.2 g
m[CO(NH2)2]==7.2 g
7.[2012·新课标全国卷,36(3)]粗铜的电解精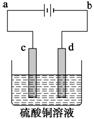 炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极________(填图中的字母);在电极d上发生的电极反应式为__________;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_________。
炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极________(填图中的字母);在电极d上发生的电极反应式为__________;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_________。
答案 c Cu2++2e-===Cu Au、Ag以单质的形式沉积在c(阳极)下方,Fe以Fe2+的形式进入电解液
解析 电解精炼时,粗铜作阳极,纯铜作阴极,CuSO4溶液作电解液,比铜活泼的金属失电子生成离子进入溶液,不如铜活泼的金属形成阳极泥沉积下来。
8.[2011·四川理综,26(5)] 按右图电解NaCl的饱和溶液,写出该电解池中发生反应的总反应方程式:________。将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的现象是________。
按右图电解NaCl的饱和溶液,写出该电解池中发生反应的总反应方程式:________。将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的现象是________。
答案 NaCl+H2O![]() NaClO+H2↑ 酚酞试液先变红后褪色
NaClO+H2↑ 酚酞试液先变红后褪色
解析 由于阳极是惰性电极,则电解饱和氯化钠溶液的方程式为2NaCl+2H2O2NaOH+H2↑+Cl2↑,生成的Cl2与NaOH溶液发生反应:Cl2+2NaOH===NaCl+NaClO+H2O,故总反应方程式为NaCl+H2ONaClO+H2↑,酚酞试液遇NaOH显红色后被HClO氧化褪色。
9.(2012·海南,16)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
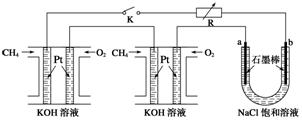
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为_______________。
(2)闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是__________,电解氯化钠溶液的总反应方程式为___________;
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为_______(法拉第常数F=9.65×104 C · mol-1列式计算),最多能产生的氯气体积为________L(标准状况)。
答案 (1)O2+2H2O+4e-===4OH- CH4+10OH--8e-=CO+7H2O
(2)H2 2NaCl+2H2O2NaOH+H2↑+Cl2↑
(3)×8×9.65×104 C·mol-1=3.45×104 C 4
解析 (1)甲烷燃料电池中正极为O2被还原,负极为CH4被氧化,在碱性条件下生成CO,其电极反应分别为O2+2H2O+4e-=4OH-、CH4+10OH--8e-=CO+7H2O。
(2)闭合K后构成闭合回路,此时a、b分别为电解池的阳极和阴极,阴极为H+得电子被还原,同时得到H2和NaOH,阳极为Cl-被氧化得到Cl2,该电解池中的总反应为2NaCl+2H2O2NaOH+H2↑+Cl2↑。
(3)每个电池通入1 L CH4,电路中通过的电量为×8×9.65×104 C·mol-1=3.45×104 C。
〖教后记〗
题组一 对金属腐蚀快慢的考查
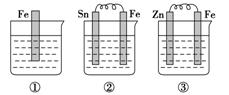
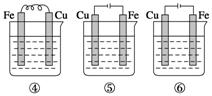
1.如图所示,各烧杯中盛有海水,铁在其中被腐蚀的速度由快到慢的顺序为( )
A.②①③④⑤⑥ B.⑤④③①②⑥
C.⑤④②①③⑥ D.⑤③②④①⑥
答案 C
解析 ①是Fe为负极,杂质碳为正极的原电池腐蚀,是铁的吸氧腐蚀,腐蚀较慢。其电极反应式:负极Fe-2e-===Fe2+,正极2H2O+O2+4e-===4OH-。②③④均为原电池,③中Fe为正极,被保护;②④中Fe为负极,均被腐蚀,但Fe和Cu的金属活泼性差别大于Fe和Sn的,故FeCu原电池中Fe被腐蚀的较快。⑤是Fe接电源正极作阳极,Cu接电源负极作阴极的电解腐蚀,加快了Fe的腐蚀。⑥是Fe接电源负极作阴极,Cu接电源正极作阳极的电解腐蚀,防止了Fe的腐蚀。根据以上分析可知铁在其中被腐蚀由快到慢的顺序为⑤>④>②>①>③>⑥。
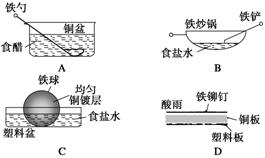
2.相同材质的铁在下图中各情形下最不易被腐蚀的是 ( )
答案 C
解析 A中,食醋作电解质溶液,铁勺和铜盆是相互接触的两个金属极,形成原电池,铁是活泼金属作负极;B中,食盐水作电解质溶液,铁炒锅和铁铲都是铁碳合金,符合原电池形成的条件,铁是活泼金属作负极,碳作正极;C中,铜镀层将铁球覆盖,使铁被保护,所以铁不易被腐蚀;D中,酸雨作电解质溶液,铁铆钉和铜板分别作负极、正极,形成原电池。
题组二 对析氢腐蚀和吸氧腐蚀的考查
3 .按如图所示装置,进行铁钉被腐蚀的实验,一周后观察(设水不蒸发)。
.按如图所示装置,进行铁钉被腐蚀的实验,一周后观察(设水不蒸发)。
(1)若试管中液面上升,发生的是__________腐蚀,则正极反应式为________________,负极反应式为__________________。要顺利完成此实验,所用的电解质溶液可以是________。
(2)若试管中液面下降,发生的是__________腐蚀,正极反应式为_______________,负极反应式为__________________。
要顺利完成此实验,所用的电解质溶液可以是___________。
答案 (1)吸氧 2H2O+O2+4e-===4OH- Fe-2e-===Fe2+ 氯化钠溶液 (2)析氢 2H++2e-===H2↑ Fe-2e-===Fe2+ 稀硫酸
解析 (1)试管中的液面上升,表明内部压强减小,即发生吸氧腐蚀,故正极反应式为2H2O+O2+4e-===4OH-,负极反应式为Fe-2e-===Fe2+;吸氧腐蚀的电解质溶液是中性或碱性溶液,如氯化钠溶液。(2)试管中的液面下降,表明发生了析氢腐蚀,则正极反应式为2H++2e-===H2↑,负极反应式为Fe-2e-===Fe2+;此时需要酸性电解质溶液,如稀硫酸等。
4.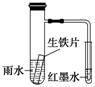 如图装置中,小试管内为红墨水,具支试管内盛有pH=4久置的雨水和生铁片。实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是( )
如图装置中,小试管内为红墨水,具支试管内盛有pH=4久置的雨水和生铁片。实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是( )
A.生铁片中的碳是原电池的阳极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.墨水回升时,碳电极反应式为O2+2H2O+4e-===4OH-
D.具支试管中溶液pH逐渐减小
答案 C
解析 生铁片中的碳是原电池的正极,A错;雨水酸性较强,开始时铁片发生化学腐蚀和析氢腐蚀,产生氢气,导管内液面下降,一段时间后铁片发生吸氧腐蚀,吸收氧气,导管内液面回升,B错;墨水回升时,铁片发生吸氧腐蚀,碳极为正极,电极反应为O2+2H2O+4e-===4OH-,C对;铁片无论是发生析氢腐蚀还是吸氧腐蚀,具支试管内溶液pH均增大,D错。
相关热词搜索:
上一篇:第十单元 电化学基础(3)
下一篇:第十一单元 电化学基础(5)
