第九单元 化学反应速率和化学平衡(4)
2015-11-20 09:44:12 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第九单元 化学反应速率和化学平衡(4)
|
|
|
授课人:董 啸 |
|
|
① 了解化学反应速率的概念,化学反应速率的表示方法。 |
|
|
教学目标: |
② 理解外界条件对化学反应速率的影响。 |
|
|
|
③ 理解化学平衡的涵义及化学反应速率之间的内在联系。
|
|
|
教学重点: |
浓度、温度、压强等条件对化学平衡移动的影响 |
|
|
教学难点: |
平衡状态的比较(等效平衡的应用);化学平衡的计算 |
|
|
教学方法: |
|
|
|
教学过程: |
第四课时 |
|
基础知识精析
四、化学平衡的应用
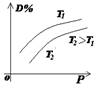
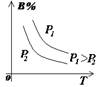
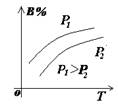
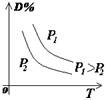
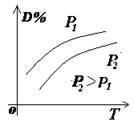
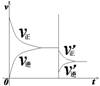
1.正确识别速率与平衡图像
(1)图像类型:
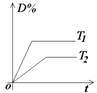
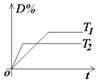
①速率-时间图像:
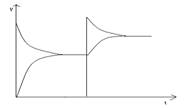
②转化率(浓度)-时间图像:
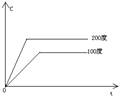
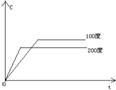
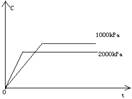

③浓度-温度(压强)图像:
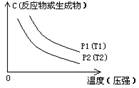
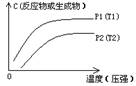
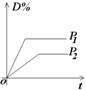
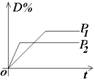
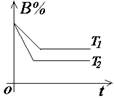
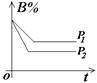
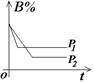
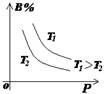
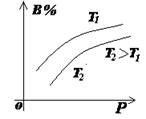
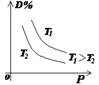
(2)常见图像:对于反应 A(g)+ 3B(g)![]() 2C(?)+ 3D(g)有以下图像,通过分析每一幅图像,确定C的状态或△H大小。
2C(?)+ 3D(g)有以下图像,通过分析每一幅图像,确定C的状态或△H大小。
(1) (2)
(3) (4)
(5) (6)

(7) (8)
(9) (10)
(11) (12)
(13) (14)
(15) (16)

(17) (18)
(3)解题方法:
改变外界条件对化学反应速率及化学平衡的影响,可用各种图象来表示,解答图象题的方法与思路是:
①看懂图象:一看面(即看清横坐标和纵坐标),二看线(即看线的走向、变化的趋势),三看点(即看线是否通过原点,两条线的交点及线的拐点),四看要不要作辅助线(如等温线、等压线),五看定量图象中有关量的多少。
②联想规律:即联想外界条件对化学反应速率和化学平衡的影响规律,且熟练准确。
③作出判断:依题意仔细分析并作出正确判断。
解答图象题常用的几条重要规律:
①控制变量:固定某一条件,观察另一条件的改变对反应的影响。
②同压强时:温度越高到达平衡所需时间就越短;
③同温度时:压强越大到达平衡所需时间就越短;
④同温同压:使用催化剂到达平衡所需时间就越短。
2.化学平衡的计算
有关化学平衡的计算有:浓度(起始浓度、转化浓度、平衡浓度)、转化率、产率、组分的质量分数以及气体的平均分子量、气体体积、密度、压强等。其计算关系有:
(1)物质浓度的变化关系
① 反应物:平衡浓度=起始浓度-转化浓度;
生成物:平衡浓度=起始浓度+转化浓度。
②各物质的变化量之比等于其在方程式中的计量数之比。
(2)反应物的转化率:
![]()
(3)产品的产率:
![]()
(4)化学平衡计算的思路:
建立模式、确定关系、列出方程、进行计算
(5)计算模式:
①列三行:
![]()
![]()
![]()
起始物质的量(mol) m n 0 0
转化物质的量(mol) ax bx cx dx
平衡物质的量(mol) m-ax n-bx cx dx
②差量法:利用反应达到平衡前后变化的差量,列式求解。
【拓展知识】平衡平衡的工业应用
1、适宜生产条件选择的一般原则
①浓度:对任一可逆反应,增大反应物浓度,能提高反应速率和转化率。故生产中常使廉价易得的原料适当过量,以提高另一原料的利用率。
②压强:对气体分子数减少的反应,增大总压使平衡向增大生成物的方向移动,反应加快;但压强太大,动力消耗大.设备要求高,成本增高,故必须综合考虑。
③温度:对放热反应,升温提高反应速率,但转化率降低,若温度太低,反应速率太慢,故需使用适当的催化剂。对于吸热反应,升温加快反应速率,又能提高转化率,但要避免反应物或生成物的过热分解,同时要考虑设备和成本的要求。
④催化剂:使用催化剂可大大提高反应速率且不影响化学平衡,但使用时必须注意其活性温度范围,且防止催化剂“中毒”,延长使用寿命。
2.合成氨工业
(1)合成氨适宜条件选择
①温度:化学反应速率分析,温度越高越好;从反应平衡分析,温度越低越好。综合考虑500℃左右为宜,且在此温度下催化剂活性最大。
②压强:从反应速率和化学平衡考虑,压强越大越有利于合成氨。但压强越大,对设备的制造和材料的强度要求越高,结合生产实际选 2×107~5×107Pa为宜。(20Mpa-50Mpa)
③催化剂:虽不影响平衡但可加快反应速率,提高单位时间氨的产量,目前工业上以铁触媒为催化剂。
④浓度:从速率和平衡角度分析,应增大氢气和氮气浓度,降低氨的浓度。
(2)合成氨工业简述
①原料气的制备、净化和压缩:制取氢气和氮气
②氨的合成:在高温、高压、催化剂作用下合成氨
③氨的分离:通过冷凝嚣将氨液化,然后将氨分离,分离出的混合气体经循环操作继续合成氨。
〖教后记〗
题组一 有关转化率、反应速率等的基本计算
1.在100 ℃时,把0.5 mol N2O4通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol·L-1。在60 s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是 ( )
A.前2 s以N2O4的浓度变化表示的反应速率为0.01 mol·L-1·s-1
B.在2 s时体系内的压强为开始时的1.1倍
C.在平衡时体系内含N2O4 0.25 mol
D.平衡时,N2O4的转化率为40%
答案 B
2.某温度下,H2(g)+CO2(g)H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
|
起始浓度 |
甲 |
乙 |
丙 |
|
c(H2)/mol·L-1 |
0.010 |
0.020 |
0.020 |
|
c(CO2)/mol·L-1 |
0.010 |
0.010 |
0.020 |
下列判断不正确的是 ( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
答案 C
题组二 综合应用
3.煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知CO(g)+H2O(g)=H2(g)+CO2(g)的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
830 |
1 000 |
|
平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有______(选填字母)
|
投料 |
A |
B |
C |
D |
|
n(CO2)/mol |
3 |
1 |
0 |
1 |
|
n(H2)/mol |
2 |
1 |
0 |
1 |
|
n(CO)/mol |
1 |
2 |
3 |
0.5 |
|
n(H2O)/mol |
5 |
2 |
3 |
2 |
(4)在830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是__________。
答案 (1)放热 (2)增大 增大 (3)BC (4)60%
4.在一固定容积的密闭容器中,保持一定温度,在一定条件下进行反应:A(g)+2B(g)=3C(g),已知加入1 mol A和3 mol B且达到平衡后生成了a mol C,请填写下列空白:
(1)平衡时C在反应混合气体中的体积分数是______________________________
(用字母a表示)。
(2)在相同实验条件下,若在同一容器中改为加入2 mol A和6 mol B,达到平衡后,C的物质的量为______ mol(用字母a表示)。此时C在反应混合气体中的体积分数______(填“增大”、“减少”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气体中的体积分数不变,则还应加入C________ mol。
(4)在同一容器中加入n mol A和3n mol B,达到平衡时C的物质的量为m mol,若改变实验条件,可以使C的物质的量在m mol~2m mol之间变化,那么n与m的关系应是____________(用字母“m”、“n”表示)。
答案 (1)a/4 (2)2a 不变 (3)6 (4)n>2m/3
相关热词搜索:
