第八单元 化学反应与能量(2)
2015-11-19 09:37:42 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第八单元 化学反应与能量(2)
|
|
|
授课人:董 啸 |
|
|
①掌握反应热、燃烧热和中和热等重要概念。 |
|
|
教学目标: |
②理解中和热测定的方法及数据处理方法,了解误差分析方法。 |
|
|
|
③掌握热化学方程式的概念及正确书写热化学方程式。 |
|
|
教学重点: |
反应热计算 |
|
|
教学难点: |
盖斯定律的应用 |
|
|
教学方法: |
分析比较法 |
|
|
教学过程: |
|
|
基础知识精析
四、反应热计算
1、盖斯定律
①化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
②化学反应不管是一步完成还是分几步完成,其总的反应热是相同的。
说明:以上是盖斯定律的两种表述形式,其实质是相同的。
[推论]
①任何化学反应的反应热和其逆反应的反应热大小相等,符号相反。
②任何化学反应,当各物质系数发生变化时,反应热的数值也随之发生相同变化。
△H=△H1+△H2+△H3 △H正=-△H逆
〖方法指导〗利用等式的恒等变形的思路,首先观察需要解决的目标化学反应的方程式,根据该反应的反应物及系数,将已知的热化学方程式整体乘以相应的系数(反应热也同时进行运算),然后进行加减合并,出现负号则移项,使合并后的方程式,左右两边和目标化学反应的方程式完全相同,这样所得的反应热的数值就是所求反应的反应热,所得的等式就是所求的化学反应的热化学方程式。
例题、已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH1=-890.3kJ·mol-1;
②C(石墨)+O2(g)=CO2(g);ΔH2=-393·5kJ·mol-1
③H2(g)+![]() O2(g)=H2O(l);ΔH3=-285.8kJ·mol-1
O2(g)=H2O(l);ΔH3=-285.8kJ·mol-1
实验中不能直接测出由石墨和氢气生成甲烷反应的ΔH,请计算反应:C(石墨)+2H2(g)=CH4(g)的反应热ΔH。
由方程式C(石墨)+2H2(g)=CH4(g)可知:通过②+③×2-①可以得到该方程式,因此该反应的反应热为:
ΔH=ΔH2+2ΔH3-ΔH1
=-393.5kJ·mol-1+2(-285.8) kJ·mol-1-(-890.3) kJ·mol-1
=-74.8kJ·mol-1
2、ΔH的比较
比较ΔH的大小时需考虑正负号,对放热反应,放热越多,ΔH越小;对吸热反应,吸热越多,ΔH越大。
3、反应热计算
(1)根据热化学方程式计算:
反应热与反应物的物质的量成正比。
(2)根据盖斯定律求算
应用盖斯定律进行简单计算时,关键在于先得出需要的热化学方程式。
注意:
①参照目标热化学方程式,结合原热化学方程式(一般2~3个)进行合理“变形”。热化学方程式颠倒、乘除以某一个数,然后将它们相加、减,得到目标热化学方程式,求出目标热化学方程式的ΔH与原热化学方程式之间ΔH的换算关系。
②当热化学方程式乘、除以某一个数时,ΔH也应相应地乘、除以某一个数;方程式进行加减运算时,ΔH也同样要进行加减运算,且要带“+”“-”符号,即把ΔH看作一个整体进行运算。
③将一个热化学方程式颠倒书写时,ΔH的符号也随之改变,但数值不变。
④在设计反应过程中,会遇到同一物质的三态(固、液、气)的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
![]() 深度思考
深度思考![]()
试比较下列三组ΔH的大小
(1)同一反应,生成物状态不同时
A(g)+B(g)===C(g) ΔH1<0
A(g)+B(g)===C(l) ΔH2<0
ΔH1____ΔH2(填“>”、“<”或“=”,下同)。
答案 >
解析 因为C(g)===C(l) ΔH3<0
则ΔH3=ΔH2-ΔH1,ΔH2<ΔH1。
(2)同一反应,反应物状态不同时
S(g)+O2(g)===SO2(g) ΔH1<0
S(s)+O2(g)===SO2(g) ΔH2<0
则ΔH1____ΔH2。
答案 <
解析 ![]()
ΔH2+ΔH3=ΔH1,则ΔH3=ΔH1-ΔH2,又ΔH3<0,所以ΔH1<ΔH2。
(3)两个有联系的不同反应相比
C(s)+O2(g)===CO2(g) ΔH1<0
C(s)+O2(g)===CO(g) ΔH2<0
则ΔH1____ΔH2。
答案 <
解析 根据常识可知CO(g)+O2(g)===CO2(g) ΔH3<0,又因为ΔH2+ΔH3=ΔH1,所以ΔH2>ΔH1。
五、能源
1.概念
能提供能量的自然资源。
2.发展阶段
柴草时期→化石能源时期→多能源结构时期。
3.分类
(1)化石燃料
①种类:煤、石油、天然气。
②特点:蕴藏量有限,且不能再生。
(2)新能源
①种类:太阳能、氢能、风能、地热能、海洋能和生物质能等。
②特点:资源丰富,可以再生,没有污染或污染很小。
4.能源问题
(1)我国目前使用的主要能源是化石燃料,它们的蕴藏量有限,而且不能再生,最终将会枯竭。
(2)化石燃料的大量使用带来严重的环境污染问题。
5.解决能源问题的措施
(1)提高能源的使用效率
①改善开采、运输、加工等各个环节。
②科学控制燃烧反应,使燃料充分燃烧。
一是保证燃烧时有适当过量的空气,如鼓入空气、增大O2浓度等。
二是保证燃料与空气有足够大的接触面积,如将固体粉碎成粉末,使液体喷成雾状等。
(2)开发新的能源
开发资源丰富、可以再生、没有污染或污染很小的新能源。
![]() 深度思考
深度思考![]()
1.2009年哥本哈根气候大会,是被称作“人类拯救地球的最后一次机会”的联合国气候变化大会。下列措施有利于节能减排、改善环境质量的是 ( )
①回收再利用废弃的塑料、金属、纸制品及玻璃等资源
②发展低碳经济、循环经济,开发推广太阳能、水能、风能等能源,减少煤、石油等化石燃料的使用 ③使用填埋法处理未经分类的生活垃圾 ④推广使用燃煤脱硫技术,防治SO2污染 ⑤研制开发新型燃料电池汽车,减少机动车尾气污染
A.①②④⑤ B.①②⑤ C.①②③④ D.③④⑤
答案 A
解析 未经分类的生活垃圾使用填埋法处理的措施不仅污染环境,还造成资源浪费,③不正确。
2.能源分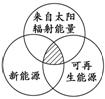 类相关图如右图所示,下列四组选项中,全部符合图中阴影部分的能源是 ( )
类相关图如右图所示,下列四组选项中,全部符合图中阴影部分的能源是 ( )
A.煤炭、石油、沼气 B.水能、生物能、天然气
C.太阳能、风能、潮汐能 D.地热能、海洋能、核能
答案 C
【探究高考】
1.判断正误,正确的划“√”,错误的划“×”
(1)使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 (×)(2009·浙江理综,7C)
解析 太阳能热水器的使用不属于生物质能的利用。
(2)石油、煤、天然气、可燃冰、植物油都属于化石燃料 (×)(2009·浙江理综,7D)
解析 植物油不属于化石燃料。
(3)开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放 (×)(2010·浙江理综,7B)
解析 无磷洗涤剂与碳的排放不相关。
(4)甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 (×)(2010·浙江理综,12A)
解析 水的状态错误。
(5)500 ℃、300 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH2(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)催化剂500 ℃、30 MPa2NH3(g) ΔH=-38.6kJ·mol-1(×)(2010·浙江理综,12B)
解析 合成氨反应为可逆反应,并不能完全转化。
(6)化学反应有新物质生成,并遵循质量守恒定律和能量守恒定律(√)(2011·浙江理综,7A)
解析 化学变化遵循能量和质量守恒。
(7)实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3 916 kJ·mol-1、-3 747 kJ·mol-1和-3 265 kJ·mol-1,可以证明在苯分子中不存在独立的碳碳双键(√)(2011·浙江理综,12C)
解析 由盖斯定律,根据环己烷和环己烯的燃烧热,则1 mol环己烷失去2 mol H即1 mol H2燃烧的反应热之和为-3 916 kJ·mol-1+3 747 kJ·mol-1=-169 kJ·mol-1;根据环己烷和苯的燃烧热,则1 mol环己烷失去6 mol H即3 mol H2燃烧的反应热之和为-3 916 kJ·mol-1+3 265 kJ·mol-1=-651 kJ·mol-1,若苯分子中存在独立的碳碳双键,则两处的反应热之比为1∶3;而显然二者的反应热之比不为1∶3,说明苯分子中不存在独立的碳碳双键。
(8)已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g) ΔH=489.0 kJ·mol-1
CO(g)+O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
C(石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
则4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1 641.0 kJ·mol-1(√)
(2011·浙江理综,12D)
解析 运用盖斯定律,将第三个反应×6-第一个反应×2-第二个反应×6,可得目标反应,则ΔH=-393.5 kJ·mol-1×6-489.0 kJ·mol-1×2-(-283.0 kJ·mol-1)×6=-1 641.0 kJ·mol-1。
(9)利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法(√) (2012·浙江理综,7A)
2.(2012·重庆理综,12)肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O===O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是 ( )
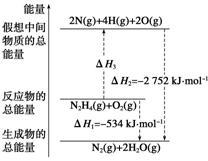
A.194 B.391 C.516 D.658
答案 B
3.(2012·大纲全国卷,9)反应 A+B―→C(ΔH<0)分两步进行:①A+B→X (ΔH >0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
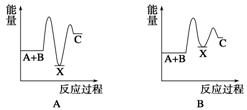
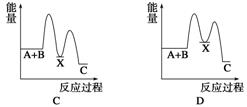
答案 D
解析 根据反应物和生成物能量的高低来分析、解决问题。化学反应都伴随能量变化,当反应物的总能量高于生成物的总能量时,该反应为放热反应;当反应物的总能量低于生成物的总能量时,该反应为吸热反应。反应①的ΔH>0,为吸热反应,故可排除A项和C项。反应②的ΔH<0,为放热反应,B项错误,故选D。
4.(2010·课标全国卷,11)已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
A.-67.7 kJ·mol-1 B.-43.5 kJ·mol-1
C.+43.5 kJ·mol-1 D.+67.7 kJ·mol-1
答案 C
解析 根据题意可得如下热化学方程式:HCN(aq)+OH-(aq)===CN-(aq)+H2O(l) ΔH=-12.1 kJ·mol-1,H+(aq)+OH-(aq)===H2O(l) ΔH=-55.6 kJ·mol-1,依据盖斯定律得到:HCN(aq)===H+(aq)+CN-(aq)
ΔH=(-12.1 kJ·mol-1)-(-55.6 kJ·mol-1)=+43.5 kJ·mol-1。
5.[2012·北京理综,26(1)]已知反应A:4HCl+O2CuO/CuCl2400 ℃2Cl2+2H2O
ⅰ.反应A中, 4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.

①H2O的电子式是____________。
②反应A的热化学方程式是____________________________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为________kJ,H2O中H—O 键比HCl中H—Cl键(填“强”或“弱”)________。
答案 ①HH ②4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1
③32 强
解析 ①H2O为共价化合物,其电子式为HH。②根据4 mol HCl被氧化放出115.6 kJ的热量,又结合反应条件为400 ℃,故其热化学方程式为4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。③根据②的热化学反应方程式和O2、Cl2的键能可知,断裂4 mol H—Cl键与1 mol O===O键需吸收的能量比生成2 mol Cl—Cl键和4 mol H—O键放出的能量少115.6 kJ,故4 mol H—O键的键能比4 mol H—Cl键的键能大:115.6 kJ+498 kJ-2×243 kJ=127.6 kJ,故断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为127.6 kJ÷4≈32 kJ;根据H—O键键能大于H—Cl键键能可知,H—O键比H—Cl键强。
6.[2011·四川理综,29(1)]已知1 g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为______________________________________。
答案 4FeS2(s)+11O2(g)===8SO2(g)+2Fe2O3(s) ΔH=-3 408 kJ·mol-1
解析 根据1 g FeS2完全燃烧放出7.1 kJ的热量,可求得1 mol FeS2完全燃烧放出的热量为852 kJ,则该反应的热化学方程式为4FeS2(s)+11O2(g)===8SO2(g)+2Fe2O3(s) ΔH=-3 408 kJ·mol-1。
7.[2012·广东理综,31(4)]碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为2Li(s)+I2(s)===2LiI(s) ΔH
已知:4Li(s)+O2(g)===2Li2O(s) ΔH1
4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH=__________;碘电极作为该电池的________极。
答案 (ΔH1-ΔH2) 正
解析 已知:①4Li(s)+O2(g)===2Li2O(s) ΔH1
②4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
据盖斯定律,由(①-②)可得:2Li(s)+I2(s)===2LiI(s) ΔH=(ΔH1-ΔH2)。
由电池反应可知,I2得电子被还原,则碘电极作为该电池的正极。
8.[2011·山东,28(2)]已知:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)SO3(g)+NO(g)的ΔH=______kJ·mol-1。
答案 -41.8
解析 设所给的两个反应方程式分别标注为2SO2(g)+O2(g)2SO3(g) ΔH1=-196.6 kJ·mol-1、2NO(g)+O2(g)2NO2(g) ΔH2=-113.0 kJ·mol-1,所求总反应方程式的ΔH为ΔH3,ΔH3===-41.8 kJ·mol-1。
〖教后记〗
题组一 反应热大小的比较和计算
1.下列各组热化学方程式中,化学反应的ΔH前者大于后者的是 ( )
①C(s)+O2(g)===CO2(g) ΔH1
C(s)+O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3
S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+O2(g)===H2O(l) ΔH5
2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.① B.④ C.②③④ D.①②③
答案 C
解析:本题主要考查对“ΔH”的理解,明确“ΔH”既有“+”、“-”,又有数值大小。碳与氧气反应放热,即ΔH1<0,ΔH2<0,CO再与O2作用时又放热,所以ΔH1<ΔH2;等量的固态硫变为气态硫蒸气时吸收热量,故在与O2作用产生同样多的SO2时,气态硫放出的热量多,即ΔH3>ΔH4;发生同样的燃烧反应,物质的量越多,放出的热量越多,故ΔH5>ΔH6;碳酸钙分解吸收热量,ΔH7>0,CaO与H2O反应放出热量,ΔH8<0,显然ΔH7>ΔH8。故本题答案为C。
2.由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:__________。若1 g水蒸气转化成液态水放热2.444 kJ,则反应2H2(g)+O2(g)===2H2O(l)的ΔH=______kJ·mol-1,氢气的燃烧热为_____kJ·mol-1。
答案:H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1 -571.6 285.8
解析:书写热化学方程式时注意:化学计量数改变时,ΔH也同等倍数的改变,故生成水蒸气的热化学方程式可写成:H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1或2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1等多种形式。36 g的水蒸气变成36 g液态水时放热36 g×2.444 kJ·g-1=88 kJ,所以2 mol H2燃烧生成2 mol H2O(l)时,ΔH=-483.6 kJ·mol-1-88 kJ·mol-1=-571.6 kJ·mol-1。氢气的燃烧热为1 mol H2燃烧生成1 mol H2O(l)时放出的热量,ΔH=-=-285.8 kJ·mol-1。
题组二 盖斯定律的应用
3.已知下列热化学方程式
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)
ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g)
ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)
ΔH3=+19 kJ·mol-1 ③
写出FeO(s)被CO还原成Fe和CO2的热化学方程式________________。
答案 FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH=-11 kJ·mol-1
解析 依据盖斯定律:化学反应不管是一步完成还是分几步完成,其反应热是相同的。FeO与CO反应方程式:FeO(s)+CO(g)===Fe(s)+CO2(g),通过观察可以发现,此反应可用题给的三个反应来表示:×[3×①-(2×③+②)],可得该反应的反应热:ΔH=[3ΔH1-(2ΔH3+ΔH2)]=×[3×(-25 kJ·mol-1)-(19 kJ·mol-1×2-47 kJ·mol-1)]=-11 kJ·mol-1。
4.已知H2SO4(aq)与Ba(OH)2(aq)反应的ΔH=-1 584.2 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则生成BaSO4(s)的反应热等于 ( )
A.-1 528.6 kJ·mol-1 B.-1 473 kJ·mol-1
C.+1 473 kJ·mol-1 D.+1 528.6 kJ·mol-1
答案 B
解析 H+(aq)+OH-(aq)===H2O(l) ΔH1=-55.6 kJ·mol-1 ①
Ba2+(aq)+SO(aq)===BaSO4(s) ΔH2 ②
2H+(aq)+2OH-(aq)+Ba2+(aq)+SO(aq)===BaSO4(s)+2H2O(l) ΔH3=-1 584.2 kJ·mol-1 ③
根据盖斯定律知,ΔH3=2ΔH1+ΔH2,ΔH2=-1 473 kJ·mol-1。
相关热词搜索:
上一篇:第八单元 化学反应与能量(1)
下一篇:第八单元 化学反应与能量(3)
