第七单元 物质结构 元素周期律(5)
2015-11-18 10:02:35 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第七单元 物质结构 元素周期律(5)
|
|
|
授课人:董 啸 |
|
|
①掌握原子构成及构成原子的微粒间的关系; |
|
|
教学目标: |
②理解元素周期律的实质及元素周期表的结构; |
|
|
|
③掌握化学键的概念和判断。
|
|
|
教学重点: |
元素周期律的实质及元素周期表的结构 |
|
|
教学难点: |
核外电子排布规律及有关规律 |
|
|
教学方法: |
分析比较法 |
|
|
教学过程: |
第五课时 |
|
高考考点透析
一、考纲要求
(1)了解原子的结构及同位素的概念。理解原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系。
(2)以第1、2、3周期的元素为例,了解原子核外电子排布规律。
(3)理解离子键、共价键的含义。理解极性键和非极性键。了解极性分子和非极性分子。了解分子间作用力。初步了解氢键。
(4)了解几种晶体类型(离子晶体、原子晶体、分子晶体、金属晶体)及其性质。
(5)掌握元素周期律的实质,了解元素周期表(长式)的结构(周期、族)及其应用。
(6)以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以IA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
二、考点透析
纵观近十年高考题,本章考试热点主要集中在以下几点:构成原子和原子核的各种粒子之间的关系;同位素、元素的相对原子质量、原子的实际质量、不同原子的比等概念的考查和量的计算; 1~20号元素和主族元素原子结构知识的考查;对三种基本类型的化学键主要共价键、离子键,涉及金属键的几乎没有;元素周期表、原子或离子结构和性质的相互推导和论证。
原子结构和同位素的考查,常以重大科技成果为知识背景,寓教于考,突出教育性与实践性,常考的考点有:
1.关于原子的组成及各基本粒子之间的关系,质量数=中子数+质子数。常常结合新发现的元素或同位素来考查,题目翻新,但题型不变,考查的知识点不变。
2.注重对电性关系的考查。依据是:中性原子中,核外电子数=质子数;阳离子中,核外电子数<质子数;阴离子中,核外电子数>质子数。此类题目有一定的难度,解题时要注意方法技巧。
3.同位素的概念及应用。要注意理解有关概含的内涵和外延,并能区分易混淆的概念如同素异形体、同分异构体等。
4.确定一定质量的某种离子中所含某一基本粒子(如电子)的数目,此类问题具有一定的综合性,常用到有关物质的量的计算。
有关原子数、中子数、质量数和电子数的计算问题,核外电子排布的规律性变化与元素性质的规律性变化的内在联系仍然会是今后高考命题的重点内容。题型为填空题或选择题。
考试热点:以选择题考查,根据短周期元素形成化合物确定元素原子序数之间的关系;已知微粒的电子层结构确定元素性质;根据元素在周期表中的位置预测未知物质的结构与性质。
本章内容在高考中常以选择题、填空题或计算题等各种题型出现。随着3+X高考制度的逐步落实,高考重点要转向利用元素周期表和元素周期律的知识来推断新元素的性质及新物质的性质和用途。
1.原子结构部分试题内容常常结合科研的新发现和新成果。结合物质的量、摩尔质量、气体摩尔体积、气体体积定律,结合有关化学方程式进行计算,具有内容变化而题型不变的特点。但概念性强,有一定的综合性,一定要注意深入理解有关概念的内涵和外延。准确区分易混淆的概念。解题才有较好的基础。
2.全面、熟练地掌握元素周期律。元素周期表及其性质变化规律、原子结构’与元素周期表的关系是非常重要的,解题时审题要细致、题意要清楚.化学用语使用要正确。
3.解答化学键类型与分子极性此类问题的依据就是有关离子键、共价键的概念,形成元素性质的差异、成键特点及;分子的主体构型等.在分析中要注意概念的特殊性和条件的;隐含性。
本部分是高考必考的内容之一,主要考查一些常见单质、化合物的晶体类型;判断晶体中基本粒子间的作用力是离子键、共价键还是分子间作用力,从而确定晶体的熔点高低。其次就是课本上出现过的晶体结构示意图。该类题目的特点:由物质的性质或粒子间的作用力确定晶体类型,依据比较晶体物理性质(主要是:硬度、熔点、沸点等)的规律,确定所给晶体硬度的大小,熔沸点的高低顺序。在解答过程中,首先要判断晶体类型,其次根据四类晶体(离子晶体、原子晶体、分子晶体、金属晶体)各自物理性质的主要影响因素(粒子间的相互作用力的强弱)进行分析比较,最后要注意看准顺序要求。 由于晶体空间结构试题能很好地考查学生的观察能力和三维空间的想象能力,因而它成为命题的热点在情理之中。考查的形式或根据空间构型求晶体的化学式或根据空间构型求晶体密度、阿伏加德罗常数、化学键数目等,常与数学和物理知识综合在一起考查,特别易与立体几何知识结合在一起。此类试题立意新颖,构思巧妙,对学生的观察思维能力、空间想象能力有较高的要求。
考试热点
1.以选择题形式考查原子组成及各粒子间的关系;微粒半径大小的比较;判断化合物电子式和原子8电子结构。
2.判断化学键类型和晶体类型,晶体的物理性质比较,晶体空间结构分析;判断常见化合物是极性分子还是非极性分子
3. 化学键类型、分子极性的判断,解此类题时的依据是有关的基本概念如共价键的概念,形成化学键元素性质的差异大小,分子的空间构型等,在分析解答过程中要注意问题的隐含性。如NH4Cl中存在共价键,全都是由非金属原子构成的,但是离子化合物存在离子键。
4. 分子结构的确定,此类题目的特点是判断常见分子、离子的电子式的书写正误,或是综合化学键的知识考查分子的空间构型及分子的形成方式。
5.晶体结构的确定及晶体物理性质的比较,此类题在高考中的比重有增大的趋势,难度也有所增加,对知识的要求比较细致深刻,应用能力要求较高。
典型试题剖析
一、高考新题赏析
1、(2012新课标)13.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说中正确的是
A.上述四种元素的原子半径大小为W<X<Y<Z
B. W、X、Y、Z原子的核外最外层电子数的总和为20
C.W与Y可形成既含极性共价键又含非极性共价键的化合物
D.有W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点
2、(2012北京高考)9.已知33As、35Br位于同一周期,下列关系正确的是
A.原子半径:As>C1>P B.热稳定性:HC1>AsH3>HBr
C.还原性:As3->S2->C1- D.酸性:H3AsO4>H2SO4>H3PO4
答案:【C】
3、(2012浙江卷)9.X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
A.原子半径:Z>Y>X
B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点
 C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂
C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂
D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1︰2
4、(2012江苏高考)12. 短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
A. 元素X 的简单气态氢化物的热稳定性比W 的强
B. 元素W 的最高价氧化物对应水化物的酸性比Z 的弱
C. 化合物YX、ZX2、WX3 中化学键的类型相同
D. 原子半径的大小顺序: rY >rZ >rW >rX
5、(2012全国卷6)下列关于化学键的叙述 , 正确的一项是(A)
A 离子化合物中一定含有离子键 B 单质分子中均不存在化学键
C 含有极性键的分子一定是极性分子 D 含有共价键的化合物一定是共价化合物
6、(2012全国卷)10 、 元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫的离子半径,X元素为 ( )
A Al B P C Ar D K
答案:D
7、(2012全国卷27)原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b和d的A2B型氢化物均为V形分子,c的+1价离子比e的-1价离子少8个电子。回答下列问题:
(1)元素a为_C _;c为__Na__(2)由这些元素形成的双原子分子为__CO_______。
(3)由这些元素形成的三原子分子中,分子的空间结构属于直线形的是__CO2__,非直线形的是 _H2S、_H2O____。(写2种)
(4)这些元素的单质或由他们形成的AB型化合物中,其晶体类型属于原子晶体的是_金刚石_,离子晶体的是_Nacl_,金属晶体的是_ Na__,分子晶体的是_CO 或S__;(每空填一种)
(5)元素a和b形成的一种化合物与c和b形成的一种化合物发生的反应常用于防毒面具中,该反应的化学方程式为_2Na2O2+2 CO2=2Na CO3+O2↑__。
8、(2012天津卷)7.(14分)X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
⑴ Y在元素周期表中的位置为________________。
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是_________(写化学式),非金属气态氢化物还原性最强的是_____________(写化学式)。
⑶ Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______(写出其中两种物质的化学式)。
⑷ X2M的燃烧热ΔH = -a kJ·mol-1 ,写出X2M燃烧反应的热化学方程式:_________________________________________________。
⑸ ZX的电子式为_____;ZX与水反应放出气体的化学方程式为______。
⑹ 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
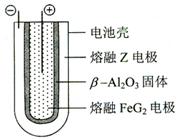 2Z + FeG2
2Z + FeG2 ![]() Fe + 2ZG
Fe + 2ZG
放电时,电池的正极反应式为_________________:
充电时,_____(写物质名称)电极接电源的负极;
该电池的电解质为___________________。
答案:7.(14分)
⑴ 第二周期第ⅥA族
⑵ HClO4 H2S
⑶ Cl2、O3、ClO2(任写两种,其他合理答案均可)
⑷ H2S (g) + O2 (g)= SO2 (g) + H2O (l);ΔH = -a kJ·mol-1
⑸ Na+[![]() ]- NaH + H2O = NaOH + H2↑
]- NaH + H2O = NaOH + H2↑
⑹ Fe2+ + 2e- = 一Fe 钠 β-Al2O3
9、(2012年安徽高考25) X、Y、Z、W是元素周期表前四周期中的常见元素。其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子L层电子数是K层电子数的2倍 |
|
Y |
Y的基态原子最外层电子排布式为:nsnnpn+2 |
|
Z |
Z存在质量数为23,中子数为12的核数 |
|
W |
W有多种化合物,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
⑴ W位于元素周期表第 周期第 族,其基态原子最外层有 个电子。
⑵ X 的电负性比Y的 (填“大”或“小”);X 和Y的气态氢化物中,较稳定的是 (写化学式)。
⑶ 写出Z2Y2与XY2反应的化学方程式,并标出电子的转移方向和数目: .
⑷ 在X的原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称: 。氢元素、X、Y的原子也可共同形成多种分子和某种常见的无机阴离子,写出其中一种分子和该无机阴离子反应的离子方程式: 。
答案:
二、经典试题回顾
1.下列说法正确的是 ( D )
A. H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B. 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C. HI的相对分子质量大于HF,所以HI的沸点高于HF
D. 由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含有共价键的离子型化合物
2.铋(Bi)在医药方面有重要应用。下列关于![]() Bi和
Bi和![]() Bi的说法正确的是
Bi的说法正确的是
A ![]() Bi和
Bi和![]() Bi都含有83个中子
Bi都含有83个中子
B ![]() Bi和
Bi和![]() Bi互为同位素
Bi互为同位素
C ![]() Bi和
Bi和![]() Bi的核外电子数不同
Bi的核外电子数不同
D ![]() Bi和
Bi和![]() Bi分别含有126和127个质子
Bi分别含有126和127个质子
3.32S与33S互为同位素,下列说法正确的是
A.32S与33S原子的最外层电子数均为2
B.32S与33S具有相同的中子数
C.32S与33S具有不同的电子数
4.![]() U是重要的核工业原料,在自然界的丰度很低。
U是重要的核工业原料,在自然界的丰度很低。![]() U的浓缩一直为国际社会关注。下列有关
U的浓缩一直为国际社会关注。下列有关![]() U说法正确的是
U说法正确的是
A ![]() U原子核中含有92个中子 B
U原子核中含有92个中子 B ![]() U原子核外有143个电子
U原子核外有143个电子
C ![]() U与
U与![]() U互为同位素 D
U互为同位素 D ![]() U与
U与![]() U互为同素异形体
U互为同素异形体
5.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A、质子数c>b B、离子的还原性Y2->Z-
C、氢化物的稳定性H2Y>HZ D、原子半径X>W
 6.X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
6.X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1 :1
D.X2Y可能是离子化合物,也可能是共价化合物
7.用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子八种微粒(离子或分子)。请回答:
⑴A元素是 ① 、B元素是 ② 、C元素是 ③ (用元素符号表示)。
⑵D是由两种元素组成的双原子分子,其分子式是 ④ 。
⑶E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 ⑤ 。
⑷F是由两种元素组成的三原子分子,其分子式是 ⑥ ,电子式是 ⑦。
⑸G分子中含有4个原子,其分子式是 ⑧ 。
⑹H分子中含有8个原子,其分子式是 ⑨ 。
【练习题(一)】
1.同一主族的两种元素的原子序数之差不可能是 ( )
A.16 B.26 C.36 D.46
2.下列关于元素周期表和元素周期律的说法错误的是
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.因Na比K容易失去电子,所以Na比K的还原性强
D.O与S为同主族元素,且O比S的非金属性强
3.下列叙述正确的是
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
4.2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期
A.钅仑 第七周期 B.镭 第七周期
C.铼 第六周期 D.氡 第六周期
5.下列说法正确的是
A ⅠA族元素的金属性比ⅡA族元素的金属性强
B ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C 同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D 第三周期元素的离子半径从左到右逐渐减小
6.W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素,它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。
请回答:
⑴ W元素是________;Z元素是________。
⑵ 化合物WY和WX2的化学式分别是_______和______。
⑶ Y和Z形成的两种常见化合物的分子式是__________和__________。
⑷ 写出X和Z形成的一种气态化合物跟WZ反应的化学方程式_____________。
7.X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”):_______,理由是____;
(2)Y是________,Z是__________,W是__________;
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1。写出该化合物的名称及化学式___________。
8.(13分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
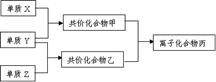
已知: a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是 。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
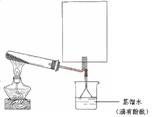
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式) 。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是 。
(4)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是 。
【练习题(二)】
1.下列说法正确的是
A 原子晶体中只存在非极性共价键
B 稀有气体形成的晶体属于分子晶体
C 干冰升华时,分子内共价键会发生断裂
D 金属元素和非金属元素形成的化合物一定是离子化合物
2.下列原子序数所对应的元素组中,两者可形成离子键的是
A.1和17 B.12和9 C.14和 6 D.15和8
3.下列叙述正确的是
A.分子晶体中的每个分子内一定含有共价键
B.原子晶体中的相邻原子间只存在非极性共价键
C.离子晶体中可能含有共价键
D.金属晶体的熔点和沸点都很高
4.短周期元家W、X、Y、Z 的原子序数依次增大,W与Y、X与Z 位于同一主族,W 与X 可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5 倍,下列叙述中不正确的是
A.WX2分子中所有原子最外层都为8 电子结构
B.WX2、ZX2的化学键类型和晶体类型都相同
C.WX2是以极性键结合成的非极性分子
D.原子半径大小顺序为X <W<Y<Z
5.下列关于粒子结构的描述不正确的是
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含一个极性键的18电子粒子
C.CH2C12和CCl4均是四面体构型的非极性分子
D.1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值)
6.NaCl的晶胞如右图,每个NaCl晶胞中含有的Na+离子和Cl-离子的数目分别是
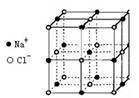
A.14,13 B.1,1 C.4,4 D.6,6
7.(14分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
⑴.V的单质分子的结构式为_______;XW的电子式为________;Z元素在周期表中的位置是_____________。
⑵.U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
⑶.U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子方程式加以证明__________________________。
⑷.YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为_________________________,由此可知VW和YW2还原性较强的是(写化学式)___________________。
〖教后记〗
相关热词搜索:
上一篇:第七单元 物质结构 元素周期律(4)
下一篇:第八单元 化学反应与能量(1)
