第三单元 氧化还原反应(3)
2015-11-04 16:33:47 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第三单元 氧化还原反应(3)
|
|
|
授课人:董 啸 |
|
|
①掌握化学反应的四种基本类型。 |
|
|
教学目标: |
②掌握重要氧化剂、还原剂之间的常见反应。 |
|
|
|
③能分析并标示氧化还原反应中电子转移的方向和数目。
|
|
|
教学重点: |
氧化性还原性强弱的比较和计算 |
|
|
教学难点: |
氧化还原反应方程式的配平及计算 |
|
|
教学方法: |
归纳法和比较法相结合 |
|
|
教学过程: |
第三课时 |
|
基础知识精析
五.氧化还原反应的计算
(1)氧化还原反应比较典型的计算类型:
①求氧化剂与还原剂物质的量之比或质量之比。
②计算参加反应的氧化剂或还原剂的量。
③确定反应前后某一元素的价态变化等。
计算的关键是依据氧化剂得电子总数等于还原剂失电子总数列出守恒关系式求解。
(2)守恒法解题的一般思路和步骤:
首先找出氧化剂、还原剂及其物质的量以及每摩尔氧化剂、还原剂得失电子的物质的量,然后根据得失电子守恒列出等式:氧化剂的物质的量×每摩尔氧化剂得电子数=还原剂的物质的量×每摩尔还原剂失电子数,利用这一等式,解氧化还原反应计算题,可化难为易,化繁为简。
注意:解决这类题时应充分抓住氧化还原反应的本质进行计算,一般不必配平氧化还原反应方程式。
练习:在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,当有3mol BrF3参加反应时,其中被水还原的BrF3的物质的量是—————mol;当有5mol H2O参加反应时,其中被水还原的BrF3的物质的量是—————mol;当有5mol H2O做还原剂时,其中被水还原的BrF3的物质的量是—————mol。
思维建模:守恒法解题的思维流程
对于氧化还原反应的计算,要根据氧化还原反应的实质——反应中氧化剂得到电子总数与还原剂失去电子总数相等,即得失电子守恒。利用守恒思想,可以抛开繁琐的反应过程,可不写化学方程式,不追究中间反应过程,只要把物质分为初态和终态,从得电子与失电子两个方面进行整体思维,便可迅速获得正确结果。
(1)找出氧化剂、还原剂及相应的还原产物和氧化产物。
(2)找准一个原子或离子得失电子数。(注意化学式中粒子的个数)
(3)根据题中物质的物质的量和得失电子守恒列出等式。
n(氧化剂)×变价原子个数×化合价变化值=n(还原剂)×变价原子个数×化合价变化值。
【活学活用】
1. Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值为 ( )
A.2 B.3 C.4 D.5
答案 D
解析 本题考查在氧化还原反应中利用得失电子守恒进行相关的计算。
![]()
得关系式1×·xe-=16×2e-,x=5。
2. 24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为 ( )
A.+2 B.+3 C.+4 D.+5
答案 B
解析 题目中指出被还原的物质是Cr,则得电子的物质必是K2Cr2O7,失电子的物质一定是Na2SO3,其中S元素的化合价从+4→+6;而Cr元素的化合价将从+6→+n(设化合价为n)。根据氧化还原反应中得失电子守恒规律,有0.05 mol·L-1×0.024 L×(6-4)=0.02 mol·L-1×0.020 L×2×(6-n),解得n=3。
3. 在P+CuSO4+H2O―→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为________mol。生成1 mol Cu3P时,参加反应的P的物质的量为________mol。
答案 1.5 2.2
解析 设7.5 mol CuSO4氧化P的物质的量为x;生成1 mol Cu3P时,被氧化P的物质的量为y根据电子守恒得:7.5 mol×(2-1)=x·(5-0)
x=1.5 mol
1 mol×3×(2-1)+1 mol×[0-(-3)]=y·(5-0)
y=1.2 mol
所以参加反应的P的物质的量为1.2 mol+1 mol=2.2 mol。
4. 四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O+O2+xOH-===Fe3O4↓+S4O+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是____________。
(2)反应的化学方程式中x=________。
(3)每生成1 mol Fe3O4,反应转移的电子为________mol,被Fe2+还原的O2的物质的量为________mol。
答案 (1)Fe2+、S2O (2)4 (3)4 0.5
解析 (2)根据电荷守恒得:
x+2×2-3×2=2,解得x=4。
(3)根据还原剂失电子总数等于氧化剂得电子总数,当生成1 mol Fe3O4时,转移的电子数即是1 mol O2得电子总数,为4 mol。设被Fe2+还原的O2的物质的量为x,根据电子守恒得:4x=1 mol×3×(-2),解得x=0.5 mol。
题组三 多步反应的得失电子守恒问题
有的试题反应过程多,涉及的氧化还原反应也多,数量关系较为复杂,若用常规方法求解比较困难,若抓住失电子总数等于得电子总数这一关系,则解题就变得很简单。解这类试题时,注意不要遗漏某个氧化还原反应,要理清具体的反应过程,分析在整个反应过程中化合价发生变化的元素得电子数目和失电子数目。
5. 现有铁粉和氧化铁的混合物共27.2 g,加入足量的稀硫酸使之充分反应。当固体粉末完全溶解时,收集到2.24 L(标准状况下)气体,当向溶液中滴加KSCN溶液时,溶液不显血红色。试求原样品中氧化铁的质量分数。
答案 58.8%
6. 14 g铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12 L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为 ( )
A.9.6 g B.6.4 g C.3.2 g D.1.6 g
答案 C
解析 根据得失电子守恒规律可直接找出已知量(O2)与未知量(Cu、Ag)之间的物质的量关系。HNO3中的元素相当于电子的“二传手”,先得到Cu、Ag失去的电子,再传给O2,最后恢复原貌,Cu、Ag失去的电子最终传给了O2,所以根据得失电子守恒规律,得
×2+=×4,解得:m(Cu)=3.2 g。
题组四 微粒先后反应时的得失电子守恒问题
当一种物质同时氧化两种或两种以上的微粒时,则强还原剂先被氧化。一种物质同时还原两种或两种以上微粒时,则强氧化剂先被还原。被氧化和被还原到何种程度,要以还原剂和氧化剂的物质的量多少来决定,具体计算时用电子守恒规律,但是对氧化还原反应过程中对应的每个阶段要分析清楚,电子守恒在对应的阶段同样适用。
7. 下列微粒在溶液中的还原性和氧化性强弱如下:还原性HSO>I-,氧
化性IO>I2>SO。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示,则x=________mol。
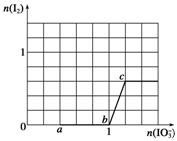
答案 3
解析 开始加入KIO3溶液时,最先与IO反应的微粒是HSO,还原产物为I-,氧化产物为SO。当HSO反应完后,b点到c点发生反应的离子方程式为IO+5I-+6H+===3I2+3H2O。所以0点到b点参加反应的HSO的物质的量可利用电子守恒求解,n(HSO)×2e-=n(IO)×6e-,即n(HSO)×2=1 mol×6,所以x=3。

1. (2012·海南,6)将0.195 g锌粉加入到20.0 mL的0.100 mol·L-1 MO溶液中,恰好完全反应,则还原产物可能是 ( )
A.M B.M2+ C.M3+ D. MO2+
答案 B
解析 锌粉加入到MO溶液中发生氧化还原反应,反应物Zn为0.003 mol,反应中失去电子为0.003 mol×2=0.006 mol,而溶液中MO为20.0×10-3 L×0.100 mol·L-1=0.002 mol,根据反应中转移电子的物质的量相等,可求得反应中M元素降低3价,即MO的还原产物可能为M2+。
2. (2012·四川理综,13)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法不正确的是( )
A.Cu与Cu2O 的物质的量之比为2∶1
B.硝酸的物质的量浓度为2.6 mol·L-1
C.产生的NO在标准状况下的体积为4.48 L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol
答案 B
解析 解题的关键是会利用守恒法解题,包括元素守恒和得失电子守恒。Cu(OH)2的质量为39.2 g,其物质的量为0.4 mol,设Cu、Cu2O的物质的量分别为x、y,则x+2y=0.4 mol,64 g·mol-1·x+144 g·mol-1·y=27.2 g,解得:x=0.2 mol,y=0.1 mol,故A正确;Cu和Cu2O中的Cu都变成了+2价,转移的电子的物质的量为(0.4+0.2) mol=0.6 mol,根据得失电子守恒可知,生成的NO应为0.2 mol,故C正确;n(NaOH)=1 mol,生成0.4 mol Cu(OH)2时消耗了0.8 mol NaOH,另外0.2 mol NaOH中和了硝酸,故D正确;硝酸总的物质的量为0.2 mol(剩余的)+0.2 mol(表现氧化性的)+0.8 mol(表现酸性的)=1.2 mol,其物质的量浓度为2.4 mol·L-1,故B错。
3. [2011·山东理综,28(1)]研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
NO2可用水吸收,相应的化学反应方程式为____________。
利用反应6NO2+8NH3![]()
![]() 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
答案 3NO2+H2O===2HNO3+NO 6.72
解析 根据题给化学方程式可知当6 mol NO2全部参加反应时,转移电子6 mol×(4-0)=24 mol,故转移1.2 mol电子时,消耗NO2 0.3 mol,即6.72 L。
4. 配平下列方程式
(1)[2011·福建理综,23(6)]在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++H2O2+H2O===Ce(OH)4↓+________
答案 2 1 6 2 6 H+
(2)[2010·福建理综,24(2)改编]完成“氧化除铁”步骤中反应的离子方程式:
Fe(OH)2+ClO-+________===Fe(OH)3+Cl-
答案 2 1 1 H2O 2 1
(3)[2011·安徽理综,27(2)改编]配平反应的离子方程式是Mn2++ClO+H2O===MnO2↓+Cl2↑+________。
答案 5 2 4 5 1 8 H+
(4)[2010·重庆理综,26(3)]配平用钙线脱氧脱磷的化学方程式:
P+FeO+CaOCa3(PO4)2+Fe
答案 2 5 3 1 5
5. (2012·上海,五)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3的反应方程式 。
(2)已知:Se+2H2SO4(浓)―→2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O―→Se+2SO+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是__________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3―→Se+I2+KNO3+H2O
②I2+2Na2S2O3―→Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.150 0 g,消耗了0.200 0 mol·L-1的Na2S2O3溶液
25.00 mL,所测定的样品中SeO2的质量分数为__________。
答案 (1)Se+2HNO3(浓)―→H2SeO3+NO↑+NO2↑
(2)H2SO4(浓)>SeO2>SO2
(3)
![]()
(4)92.5%
解析 (3)可以采用化合价升降法配平,即Se元素化合价由+4降低为0,而I元素化合价由-1升高至0,根据化合价升降相等,KI系数为4,故I2系数为2,然后配平即可;该反应中KI中的I元素失电子,而SeO2中Se元素得电子。
〖教后记〗
相关热词搜索:
上一篇:第三单元 氧化还原反应(2)
下一篇:第三单元 氧化还原反应(4)
