第一单元 物质分类(1)
2015-11-02 15:44:30 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第一单元 物质分类(1)
|
|
|
授课人:董 啸 |
|
|
①了解溶液的含义、组成和溶质的质量分数的概念。 |
|
|
教学目标: |
②了解溶解度的概念,了解温度对溶解度的影响及溶解度曲线。 |
|
|
|
③了解胶体的概念及其重要性质和应用。 |
|
|
教学重点: |
溶解度及质量分数的概念及计算、胶体的性质 |
|
|
教学难点: |
溶解度及质量分数的概念及计算、胶体的性质 |
|
|
教学方法: |
分析比较法、讲练结合 |
|
|
教学过程: |
第一课时 |
|
基础知识精析
一、物质分类的方法
用不同方法对常见物质及化学反应的分类。常见的分类法有交叉分类法和树状分类法。
1、交叉分类法
(1)定义:交叉分类法就是指对一组事物进行分类时,应用两种或两种以上的分类方法进行分类的做法。
(2)特点:可以弥补单一分类方法的不能准确定位的不足;分类方法比较麻烦是交叉分类法的缺点。
(3)适用范围:适用于并列关系的物质的分类。
2、树状分类法
(1)定义:树状分类法是指按照事物之间的从属关系把同类事物进行分类,从而认识事物之间的相互关系的一种分类方法。
(2)特点:树状分类法可以把同类事物进行再分类,从而看清楚事物之间的关系。
(3)适用范围:适用于从属关系的物质的分类。
二、物质分类的应用

1. 纯净物和混合物
纯净物: 由同种物质组成的物质。
混合物:由两种或两种以上物质组成的物质。
2. 单质和化合物
单质:由同种元素组成的纯净物。单质分成金属单质、和非金属单质。
化合物:由不同种元素组成的纯净物。化合物可分为酸、碱、盐、氧化物等。
说明: 按照原子间的相互作用化合物可分为离子化合物和共价化合物。
(1)离子化合物:由阴、阳离子相互作用而构成的化合物叫离子化合物。例如,NaCl、NaOH、NH4Cl、Na2CO3等等。
(2)共价化合物:不同元素的原子间以共用电子对形成分子的化合物叫做共价化合物。例如,H2O、CO2、HCl、H2SO4等等
3.无机物和有机物
有机物:含碳的化合物叫做有机化合物,简称有机物。CO、CO2、CaCO3等少数物质除外。
无机物:一般指组成里不含碳元素的物质,叫做无机化合物,简称无机物。
【思考与交流】
1.判断下列说法是否正确?若不正确,说出理由。
①元素在自然界的存在形式有原子、分子或离子。
②在化学变化中,分子可以再分,离子和原子不可以再分。
③同一种元素可能有多种不同原子,同一种原子也可能形成不同的离子。
④原子与该原子形成的离子相对质量几乎相等。
⑤由一种元素组成的物质一定是同一种物质。
⑥物质的化学性质一定是由分子保持的。
⑦含有质子数、中子数和电子数都相同的粒子一定是同一种粒子。
2.判断下列说法是否正确,若不正确,请简述理由。
①非金属氧化物一定是酸性氧化物。
②酸性氧化物不一定是非金属氧化物。
③金属氧化物一定是碱性氧化物。
④碱性氧化物一定是金属氧化物。
⑤Na2O和Na2O2均能与H2O反应生成NaOH,故二者都是碱性氧化物。
⑥能与酸反应生成盐和水的氧化物一定是碱性氧化物。
⑦能与碱反应生成盐和水的氧化物一定是酸性氧化物。
![]()
1. 判断下列说法是否正确?若不正确,说出理由。
①元素在自然界中的存在形式有原子、分子或离子。
②在化学变化中,分子可以再分,离子和原子不可以再分。
③同一种元素可能有多种不同原子,同一种原子也可能形成不同的离子。
④原子与该原子形成的离子相对原子质量几乎相等。
⑤由同一种元素组成的物质一定是同一种物质。
⑥物质的化学性质一定是由分子保持的。
⑦质子数、中子数和电子数都相同的粒子一定是同一种粒子。
答案 ①正确;②错误,在化学变化中复合离子如NH等可以再分;③正确;④正确;⑤错误,金刚石、石墨均是由C元素组成,但不是同一种物质,互为同素异形体;⑥错误,如Fe是由原子构成的,化学性质由铁原子保持;⑦错误,如N2和CO。
2.下列各组物质能真实表示物质分子组成的是 ( )
A.NO、C2H5OH、HNO3、I2 B.CaO、N2、HCl、H2O
C.NH3、H2S、Si、CO D.CO2、SiO2、CH3COOH、H2SO4
答案 A
解析 CaO是离子化合物,不存在分子;而Si和SiO2都是由原子直接构成。
3. 下列物质中肯定为纯净物的是 ( )
A.只由一种元素组成的物质 B.只由一种原子组成的物质
C.只由一种分子组成的物质
D.只由一种元素的阳离子与另一种元素的阴离子组成的物质
答案 C
解析 只由一种元素的一种原子构成的物质可以是同素异形体形成的混合物,如O2和O3的混合物;只由一种元素的不同价态的阳离子与另一种元素的不同价态的阴离子可以构成混合物,如Na2O和Na2O2。
4.关于某混合物的说法正确的是 ( )
A.物质的组成元素一定是两种或两种以上 B.构成物质一定是化合物
C.构成物质一定是单质 D.构成物质可能只有一种元素
答案 D
解析 同种元素形成的不同单质混合可形成混合物。
5.下列物质中属于纯净物的一组是 ( )
①冰水混合物 ②爆鸣气 ③铝热剂 ④普通玻璃 ⑤水玻璃 ⑥漂白粉 ⑦二甲苯 ⑧TNT ⑨溴苯 ⑩C5H10 ⑪含氧40%的氧化镁 ⑫花生油 ⑬福尔马林 ⑭密封保存的NO2气体
A.②③④⑥ B.⑦⑩⑫⑬⑭ C.①⑧⑨⑪ D.①④⑧⑨⑪⑫
答案 C
解析 ①的组成是水分子;⑦有邻、间、对之分;⑩存在同分异构体;⑭中NO2和N2O4共存。
归纳总结:纯净物和混合物的区别
|
纯净物 |
混合物 |
|
有固定的组成和结构 |
无固定的组成和结构 |
|
有一定的熔、沸点 |
无一定的熔、沸点 |
|
保持一种物质的性质 |
保持原有物质各自的性质 |
常见混合物:①分散系(如溶液、胶体、浊液等);②高分子(如蛋白质、纤维素、聚合物、淀粉等);③常见特殊名称的混合物:石油、石油的各种馏分、煤、漂白粉、碱石灰、福尔马林、油脂、天然气、水煤气、铝热剂等。
三.分散系
1、分散系:
(1)分散系:一种或一种以上的物质分散到另一种物质中所得到的混合物叫分散系。
分散质:被分散的物质。
分散剂:能分散分散质的物质。
(2)分类:
①按照分散质粒子的大小
按照分散质粒子大小不同分散系可以分为溶液、浊液和胶体。
当分散剂为液态时,分散系可以分为溶液、浊液和胶体。一般来说,溶液分散质粒子小于1nm,浊液中粒子通常大于100nm,粒子大小介于1nm~100nm的为胶体。
![]()
②按照分散质和分散剂的状态
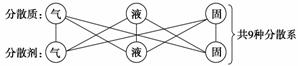
2、溶液
(1)定义:一种或一种以上的物质分散到另一种物质里,形成均一的、稳定的混合物叫做溶液。
①溶剂:能溶解其他物质的物质叫做溶剂。水是常用的溶剂,酒精、汽油等也常用来溶解碘、油脂等。
②溶质:被溶剂所溶解的物质叫做溶质。固体、液体、气体都可做溶质。例如食盐、浓硫酸、二氧化碳等均可作溶质溶解在水里。
(2)性质:
①溶质在溶解的过程中,有的放出热量,有的吸收热量。例如,氢氧化钠溶于水时放热,硝酸铵溶于水时吸热。
②有的溶液是无色的,有的溶液是有色的。例如,氯化钠溶液是无色溶液,硫酸铜溶液是蓝色溶液。
【说明】溶解时的吸热和放热现象的原因是,在溶解过程中发生了两种变化:一种是溶质的分子(或离子)向水中扩散,这一过程吸收热量;另一种是溶质的分子(或离子)和水分子作用,生成子(或水合离子),这一过程放出热量。溶质溶解时,若扩散过程吸收的热量大于水合过程放出的热量,表现为溶液温度降低;若扩散过程吸收的热量小于水合过程放出的热量,表现为溶液的温度升高;若扩散过程吸收的热量等于水合过程放出的热量,表现为溶液的温度基本不变。
(3)饱和溶液和不饱和溶液
①饱和溶液:在一定温度下,在一定量的溶剂里,不能再继续溶解某种溶质的溶液叫做这种溶质的饱和溶液。
特点:溶质溶解量已达到溶解度允许的最大量。饱和溶液在温度、溶剂量不变时,未溶解的溶质不再减少,也不增大。饱和溶液相对稳定,饱和溶液里存在溶解平衡。温度一定,饱和溶液的质量分数一定。
②不饱和溶液:在一定温度下,在一定量的溶剂里,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
特点:在一定的温度时,不饱和溶液还能继续溶解该溶质。不饱和溶液的质量分数小于同温同溶质的饱和溶液的质量分数。不饱和溶液里未达到溶解平衡。
3.溶解度:
(1)定义:在一定温度下,某物质在100克溶剂里达到饱和状态时所溶解的质量,叫做该物质在这种溶剂里的溶解度。
![]()
注意:指明温度,因为物质的溶解度随温度的改变而改变,温度不同,物质的溶解度不同。
(2)影响溶解度的因素: 溶质本身的性质;溶剂的类别;外界条件,如温度、压强等。
温度的影响:
①同种溶质在同种溶剂里因温度不同溶解度不同。
②大多数固体物质的溶解度随温度升高而加大,例如硝酸钾等;少数固体物质的溶解度受温度影响很小,例如食盐;极少数固体物质的溶解度随着温度的升高而减小,例如熟石灰等。
【说明】由于压强对固体物质在液体里的影响不明显,因而固体的溶解度可以忽略压强的影响。
(3)气体物质的溶解度影响因素
气体的溶解度不仅取决于气体的性质,还取决于压强和温度。当温度不变时,随着压强的增大、气体的溶解度也增大;当压强不变时,一般随着温度升高而减小。
一般来说,沸点低、难液化的气体溶质在非极性有机溶剂里溶解度较大,而在水中溶解度小。沸点较高、易液化的气体溶质则较易溶于水。相似相溶原理,即极性分易溶于极性分子,非极性分子易溶于非极性分子。
4.溶解度曲线:
(1)定义:以纵坐标表示物质的溶解度,横坐标表示溶的温度,根据物质在不同温度时的溶解度在坐标系上绘制的曲线就是该物质的溶解度曲线。
(2)意义:
①可以反映某物质在不同温度时的溶解度,溶解度曲线上的点表示该溶质在该点所示温度的溶解度,此时溶液处于饱和状态。
②清晰地表示了随温度变化时物质的溶解度的变化趋势。
③可以比较不同的物质在相同温度时溶解度的差异,两条溶解度曲线的交叉点表示在该点的两种溶质的溶解度相等。
④溶解度曲线上的点,表示溶解平衡状态,此时的溶液是饱和溶液。溶解度曲线下方的点,表示的是不饱和溶液。溶解度曲线上方的点表示的是过饱和溶液,很不稳定,易析出溶质。
⑤利用溶解度曲线图提供的数据可以进行相关的计算。根据物质在不同温度时溶解度的变化趋势可以选择合适的结晶方法。如随温度变化溶解度变化幅度大的物质宜采用降温结晶的方法,而对变化幅度小的物质则适合用蒸发溶剂的方法使晶体析出。
(3)溶解度曲线的变化规律
①大多数物质的溶解度随温度的升高而增大,曲线为“陡升型”,如KN03。
②少数物质的溶解度受温度影响很小,曲线为“缓升型”,如NaCl。
③极少数物质的溶解度随温度的升高而减小,为“下降型”,如Ca(0H)2。
(4)溶解度曲线的应用
①可以查出同一溶质在不同温度下的溶解度,并根据溶解度判断溶解性。
②可以比较同一温度下,不同溶质溶解度的大小。
③可以判断不同溶质的溶解度受温度影响变化的总趋势以及变化的程度,并据此确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。
④确定一定质量的某物质的饱和溶液降温时析出晶体的质量以及比较不同物质析出晶体的多少。


5.溶解性:
(1)定义:溶解性是指一种物质溶解在另一种物质里的能力,它与溶质、溶剂的性质有关。
(2)溶解度和溶解性的区别:
①溶解性只是一般地说明某物质在某种溶剂里溶解能力的大小的一种定性表示,是物质的一种物理性质。通常用易溶、可溶、微溶、难溶或不溶等粗略的概念表示,但它也有在一定范围内定量的意义。
②溶解度是衡量物质在某种溶剂里溶解性大小的尺度,是溶解性的定量的表示方法,是在一定的温度、压强下,在一定量的溶剂里制成饱和溶液时,所溶解的溶质的质量。
③溶解性与溶解度不同,溶解性是指一种物质溶解在另一种物质里的能力的大小,而溶解度要用所溶解的溶质的质量表示溶解的具体数值。
【说明】20℃时,通常溶解度在10克以上称为易溶;溶解度大于1克称为可溶;溶解度小于1克称为微溶;溶解度小于0.001克称为难溶;绝对不溶的物质是没有的。
〖板书设计〗 基础知识精析
一、物质分类的方法
1、交叉分类法 2、树状分类法
二、物质分类的应用
1. 纯净物和混合物 2. 单质和化合物 3.无机物和有机物
三.分散系
1、分散系 2、溶液 3.溶解度 4.溶解度曲线 5.溶解性
〖教后记〗
上一篇:第三节 氧化还原反应(公开课)
下一篇:第一单元 物质分类(2)
