第三节 氧化还原反应(公开课)
2015-10-20 09:14:53 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第三节 氧化还原反应(公开课)
|
三维目标: |
|
|
|
①在复习反应类型,使学生了解化学反应有多种不同分类方法。 |
|
知识与技能: |
②从得氧、失氧的角度划分氧化反应和还原反应。 |
|
|
③掌握从化合价角度对化学反应进行分类的方法,培养学生归类概括、能力。 |
|
过程与方法: |
①培养学生科学探究的基本方法,提高科学探究的能力。 |
|
|
②培养学生的思维能力和对概念的理解能力。 |
|
情感、态度 |
对学生进行对立统一等辩证唯物主义观点的教育,使学生形 |
|
与价值观 |
成勇于创新的习惯、培养创新能力。 |
|
教学重点: |
判断一个反应是否是氧化还原反应的方法 |
|
教学难点: |
氧化还原反应的实质 |
|
教学方法: |
设疑、启发、讨论、讲解 |
|
教学准备: |
多媒体课件 |
|
教学过程: |
|
第三节 氧化还原反应
[过渡]在初中化学中我们认识了许多化学反应,它们从反应物和生成物的组成进行分类共有四种基本反应类型,分别是化合反应、分解反应、置换反应和复分解反应。那么,请问同学们Fe2O3+3CO ![]() 2Fe+3CO2属于上述四种基本反应类型中的哪一种?
2Fe+3CO2属于上述四种基本反应类型中的哪一种?
【结论】不属于基本反应类型中的任何一种,四种基本反应类型的分类方法只是从形式上划分,不能反映化学反应的本质,也不能包括所有的化学反应。 按照反应物和生成物的类别及种类来区分化学反应有局限性还不能解决所有反应的分类问题。
[过渡]从前面知识我们知道,初中化学中对化学反应的认识还不够准确,所以下面我们通过探究来了解一种新的分类方法,认识一类非常重要的反应——氧化还原反应。Fe2O3+3CO![]() 2Fe+3CO2属于什么类型呢?
2Fe+3CO2属于什么类型呢?
【学法指导】
提出问题→进行探究→得出结论
【分析】在进行探究时,一般采取三步走的方法。首先提出问题,然后针对问题进行探究,并发现有关规律,最后进行归纳整理,得出结论。
【探究主题】一、什么是氧化还原反应
[温故而知新]在初中化学中我们曾经学习过氧化反应和还原反应,什么是氧化反应?什么是还原反应?
氧化反应:物质得到氧的反应叫做氧化反应。
还原反应:物质失去氧的反应叫做还原反应。
[探究问题]1、请同学们从得氧和失氧的角度分析以下几个化学反应,讨论并交流它们属于氧化反应还是还原反应?通过分析探究,说明氧化反应和还原反应是否同时发生?
① C+2CuO![]() 2Cu+CO2↑ ② H2+CuO
2Cu+CO2↑ ② H2+CuO![]() Cu+H2O
Cu+H2O
③ Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
[探究发现]从得失氧的角度分析,在C+2CuO![]() 2Cu+CO2↑反应中,CuO失氧发生了还原反应, C得氧生成CO2发生了氧化反应,所以从整体上看既发生了氧化反应,又发生了还原反应,而且氧化反应和还原反应同时发生。
2Cu+CO2↑反应中,CuO失氧发生了还原反应, C得氧生成CO2发生了氧化反应,所以从整体上看既发生了氧化反应,又发生了还原反应,而且氧化反应和还原反应同时发生。



由于氧化反应和还原反应同时进行的,所以将一个反应称为氧化反应或还原反应就不合适,所以我们通常称这种反应为氧化还原反应。
【探究结论】
氧化还原反应:在反应中某些物质被氧化的同时还有某些物质被还原(即氧化反应和还原反应同时进行)的反应,叫做氧化还原反应。
【特别说明】氧化还原反应是按照新的分类标准对化学反应进行分类的结果,所以必然有些化学反应是氧化还原反应,有些化学反应不是氧化还原反应,我们称为非氧化还原反应。
【质疑】化学反应有很多种,有些化学反应有氧元素参加,还有许多化学反应没有氧元素参加,我们无法从得失氧的角度来判断它们是否属于氧化还原反应。例如:2Na+Cl2 ![]() 2NaCl、2HI = H2 + I2 、Zn + CuCl2 = ZnCl2 + Cu 、Na2S + 2HCl = 2NaCl + H2S↑。那么如何知道它们是否属于氧化还原反应呢?
2NaCl、2HI = H2 + I2 、Zn + CuCl2 = ZnCl2 + Cu 、Na2S + 2HCl = 2NaCl + H2S↑。那么如何知道它们是否属于氧化还原反应呢?
【过渡】由此可见,从得失氧角度分析氧化还原反应有一定的局限性,不能反映化学反应的本质。我们发现化学反应中,元素化合价在反应前后通常有变化,所以我们从化合价变化的角度来分析氧化还原反应。究竟什么样的化学反应才是氧化还原反应呢?让我们继续探究。
【探究主题】二、什么样的反应是氧化还原反应?
[探究问题] 2、以碳和氧化铜反应、氢气与氧化铜的反应、一氧化碳、三氧化二铁以及铁与硫酸铜反应为例来分析,氧化还原反应与元素化合价的升降有什么关系?
【探究发现】

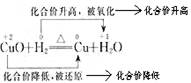

引导学生归纳:①氧化还原反应中一定有化合价变化。②元素化合价升高的反应是氧化反应;元素化合价降低的反应是还原反应。
【探究结论】:氧化还原反应的判断方法
①凡是有元素化合价升降的化学反应都是氧化还原反应;凡是没有元素化合价升降的化学反应都不是氧化还原反应(即非氧化还原反应)。
②元素化合价升高的是氧化反应;元素化合价降低的是还原反应。
说明:氧化反应不一定得到氧,还原反应不一定失去氧。利用化合价升降,不仅能分析有得氧失氧的化学反应,也能分析无得氧失氧的化学反应。
【过渡】掌握了这个有力武器我们就可以很容易的判断一个化学反应是否氧化还原反应,同时还可以知道哪些物质发生氧化反应,哪些物质发生还原反应。
【活学活用】
1、根据化合价变化情况分析,下列反应中属于氧化还原反应的是( ),属于非氧化还原反应的是( )。
A、2Na+Cl2![]() 2NaCl B、CaCO3高温CaO+CO2↑
2NaCl B、CaCO3高温CaO+CO2↑
C、Mg+2HCl=MgCl2+H2↑ D、![]()
![]()
E、Na2O+H2O=2NaOH F、CaCO3+2HCl=CaCl2+H2O+CO2↑
2、分析以下反应中的各元素化合价变化情况,判断该反应是否氧化还原反应,若是氧化还原反应请指出哪种物质发生氧化反应,哪种物质发生还原反应?
①CO2+C高温2CO ②Zn+CuSO4= ZnSO4+Cu ③H2+Cl2![]() 2HCl
2HCl
④C+2H2SO4△CO2↑+2SO2↑+2H2O ⑤NaCl+AgNO3=NaNO3+AgCl↓
【过渡】通过初中化学学习,我们知道化学反应的实质是原子之间的重新组合,元素的化合价变化和电子的转移有密切关系。前面我们探究了从化合价升降的角度分析了氧化还应反应,而元素化合价的升降仅为表面现象,要想揭示氧化还原反应的本质,还应该继续探究氧化还原反应与电子转移有的关系,下面我们就从电子转移的角度来认识氧化还应反应。
【探究主题】三、氧化还原反应的本质是什么?
【探究问题】3、请同学们通过氯气分别与钠和氢气的反应,分析电子转移与氧化还原反应的关系。
①氯气与钠反应:
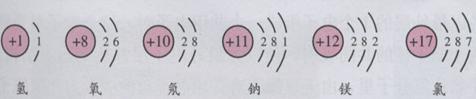
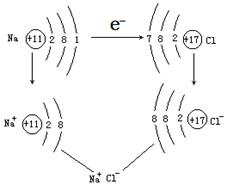

【探究发现】在以上反应中,钠原子失去最外层的1个电子成为带正电荷的钠离子,化合价由0价升高到+1价,被氧化;氯原子得到1个电子成为带负电荷的氯离子,化合价由0价降低到-1价,被还原;最终生成NaCl。
Na:失去电子,化合价升高,被氧化,发生氧化反应;
Cl:得到电子,化合价降低,被还原,发生还原反应。
【总结】:有电子得失的化学反应是氧化还原反应。

②氯气与氢气反应:


【探究发现】在 以上反应中,电子转移过程中,H原子未完全失去电子,而氯原子未完全得到电子,它们之间只有共用电子对的偏移,且共用电子对偏离于H原子而偏向于氯原子,使氢元素的化合价从0价升高到+1价,被氧化;氯元素的化合价从0价降低到-1价,被还原。
H:电子对偏离,化合价升高,发生氧化反应;
Cl:电子对偏向,化合价降低,发生还原反应。
没有电子得失只是电子对的偏移化学反应,也是氧化还原反应。
【探究结论】氧化还原反应的实质:
①氧化反应:元素的原子失去电子(或电子对偏离)的反应是氧化反应;
还原反应:元素的原子得到电子(或电子对偏向)的反应是还原反应。
②凡是有电子转移(电子得失或偏移)的反应都是氧化还原反应,凡是没有电子转移的反应都不是氧化还原反应(即非氧化还原反应)。
【活学活用】
利用电子转移分析下列反应是否氧化还应反应,若是氧化还原反应请指出在反应中哪种物质被氧化?哪种物质被还原?
①CaCO3受热分解放出CO2 ②以MnO2为催化剂,KClO3分解放出O2
③铁与稀硫酸反应 ④固体NaCl与浓H2SO4反应放出HCl气体
⑤Fe + CuSO4 = FeSO4 + Cu ⑥AgNO3 + NaCl = NaNO3 + AgCl ↓
![]() ⑦3CO + Fe2O3 2Fe +CO2
⑦3CO + Fe2O3 2Fe +CO2
![]() ⑧2KMnO4 K2MnO4 + MnO2 +O2↑
⑧2KMnO4 K2MnO4 + MnO2 +O2↑
【分享与交流】我们这节课通过探究,认识了氧化还原反应,你有什么收获?请与大家分享?
①氧化还原反应的概念:
在反应中某些物质被氧化的同时还有某些物质被还原(即氧化反应和还原反应同时进行)的反应,叫做氧化还原反应。
②氧化还原反应的判断:
凡是有化合价变化或电子转移(电子得失和电子对偏移)的反应都是氧化还应反应,凡是没有化合价变化或电子转移的反应都是非氧化还应反应。
③氧化反应和还原反应的判断:
氧化还原反应的实质是有电子转移,表现为有元素化合价升降(或变化)。
氧化反应表现为元素化合价升高,实质是元素的原子失去电子(或电子对偏离)的反应。
还原反应表现为元素的化合价降低,实质是元素的原子得到电子(或电子对偏向)的反应。
【小窍门】失去电子→化合价升高→氧化反应;得到电子→化合价降低→还原反应。 口诀:失升氧,得降还。
【自主探究】
四种基本反应类型与氧化还原反应属于两种不同的分类方法,四种基本反应类型与氧化还原反应的关系是什么?请画出两者关系的维恩图。
[探究问题]化合反应、分解反应、置换反应、复分解反应都。
[探究结论]①置换反应都是氧化还原反应。②复分解反应都不是氧化还原反应。③化合反应与分解反应部分是氧化还原反应,其中有单质参加的化合反应与有单质生成的分解反应肯定是氧化还原反应。
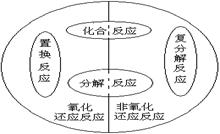
【结束语】探究是人类社会发展的永恒的主题,人类只有不断的探究才会有发展。让我们在探究中不断的成长,不断提高,不断进步吧!
【学以致用】
1、有人说置换反应、有单质参加的化合反应和有单质参加的分解反应都属于氧化还原反应。你认为这个说法正确吗?请说明你的理由。请分析四种基本反应类型的反应与氧化还原反应之间的关系,并试着画出它们之间的交叉分类示意图,然后列举一些具体的化学反应加以说明。
2、下列反应属于氧化还原反应的是( )
A、CaCO3+2HCl=CaCl2+H2O+CO2↑ B、CaCO3高温CaO+CO2↑
C、Na2O+H2O=2NaOH D、Mg+2HCl=MgCl2+H2↑
3、下列叙述正确的是( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、 凡有元素化合价升降的化学反应都是氧化还原反应
C、 在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的得失或偏移
[引入]最近,在我国航天事业中发生了几件大事大家知道是什么事情吗?




2011年9月29日中国自行研制的天宫一号发射升空。2011年11月1日,中国自行研制的神舟八号飞船发射升空。2011年11月3日,神舟八号飞船与天宫一号目标飞行器在陕西上空对接成功,为我国建设空间站迈出关键一步,我国也成为继美国和俄罗斯之后第三个掌握对接技术的国家。
这是我们中国人的骄傲更是陕西人的骄傲,因为设计、发射的许多关键技术在我们西安完成,测控中心在我们陕西,就连对接都在我们陕西上空进行。当我们看到火箭发射升空的壮观场景时,可能还没有想到,火箭发射离不开氧化还原反应所释放的巨大的能量,那么究竟什么是氧化还原反应呢?
相关热词搜索:第三节
上一篇:第四章 单元复习
下一篇:第一单元 物质分类(1)
