第四节 氨 硝酸 硫酸(3)
2015-10-20 09:13:47 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第四节 氨 硝酸 硫酸(3)
|
三维目标: |
|
|
|
①了解硝酸的物理性质和用途。 |
|
知识与技能: |
②掌握硝酸的化学性质(强氧化性、不稳定性)。 |
|
|
③了解简单氧化还原反应方程式的配平。 |
|
过程与方法: |
①通过分析硝酸中氮元素化合价,学会预测元素的性质。 |
|
|
②培养学生的实验能力、观察能力、分析能力。 |
|
情感、态度 |
通过介绍化学家的故事,使学生树立热爱科学;通过浓硝酸 |
|
与价值观 |
和稀硝酸性质的比较,让学生了解量变引起质变的道理。 |
|
教学重点: |
硝酸的不稳定性和强氧化性 |
|
教学难点: |
硝酸的不稳定性和强氧化性 |
|
教学方法: |
分析比较法和实验分析法结合 |
|
教学准备: |
多媒体课件、实验用品 |
|
教学过程: |
第三课时 |
[导入] 玻尔巧藏诺贝尔金奖章:丹麦有位叫玻尔的科学家,37岁时他获得了1922年的诺贝尔奖。第二次世界大战期间,玻尔被迫离开即将被德军占领的祖国,为了表示他一定要返回祖国的决心,他决定将诺贝尔奖章留在实验室。玻尔把金奖章溶解在盛有王水试剂瓶里。后来,纳粹分子窜入玻尔实验室,那个试剂瓶就在他们的眼皮底下,他们却一无所知。战争结束后,玻尔从王水中把金还原出来,并重新铸成奖章,而玻尔配制王水的主要组成之一是“硝酸”。
三、硝酸的性质
【思考与交流】请同学们分析硝酸中氮元素的化合价,推测硝酸所具有的性质?
【结论】在硝酸中氮元素的化合价为+5价,所以在化学反应中表现出氧化性,与不同的反应物或不同的反应条件,生成不同的低价态的氮:NO2、HNO2、NO、N2O、N2、NH3.
1、氧化性
(1)与金属反应:
[设疑]硝酸有酸性,能否与金属反应放出氢气?
[演示实验] Cu分别与浓硝酸和稀硝酸反应实验。比较浓硝酸、稀硝酸分别与Cu反应。
〖实验现象〗
①Cu与浓硝酸:剧烈反应,有大量红棕色气体产生,溶液颜色由无色变为绿色,反应放出大量的热量。
②Cu与稀硝酸:反应缓慢,有无色气泡产生(在空气中无色变为红棕色),溶液颜色由无色变为蓝色,反应放热。
[分析]浓HNO3与Cu反应产生红棕色气体,说明是NO2,则硝酸被还原,表现氧化性。稀HNO3与Cu反应产生无色气体,遇到空气变成红棕色,说明是NO,则硝酸也被还原,表现氧化性。同时溶液都变成蓝色,则Cu被氧化成+2价。从实验现象“红棕色气体生成”判断生成物中是NO2而非H2。进一步从氧化还原反应说明反应的本质是+5价的氮得电子能力比H+强。
Cu +4HN03(浓)=Cu(NO3)2 + 2NO2↑+ 2H20
3Cu +8HN03(稀) ![]() 3Cu(NO3)2 + 2NO↑+ 4H20
3Cu(NO3)2 + 2NO↑+ 4H20
【探究实验】一般稀硝酸与铜反应时也有少量红棕色的NO2生成,请设计一个实验证明,铜与稀硝酸反应只产生NO而没有NO2。实验成败的关键是什么?隔绝空气。
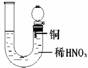
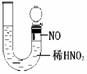
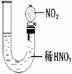
[说明]①硝酸与Cu反应,硝酸的浓度不同,被还原的产物中N元素的价态也不同。通过这点可以说明,硝酸在与其他物质反应时,反应物或反应条件不同,硝酸被还原的产物也不相同。
②除金、铂等少数金属外,硝酸几乎能与所有金属反应;
③当浓硝酸与浓盐酸按体积比为1:3混合时,就配制成 “王水”,王水的氧化性比浓硝酸强,可以溶解金、铂等不溶于硝酸的金属。
④铁、铝与冷的浓硫酸或浓硝酸常温下发生钝化。
[实验]浓硝酸与铝片反应。
[现象] 浓硝酸与铝片看不到明显的反应。
[讲解]钝化原理:铁、铝与冷的浓硫酸或浓硝酸,表面被氧化为牢固的氧化物薄膜,阻止酸与内层金属进一步反应。
[提问]浓硝酸的运输和贮存可用何种物质制的容器?
[设问]比较浓硫酸的性质,浓硝酸能否与非金属反应?
(2)与非金属反应:
C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
S+6HNO3(浓)=H2SO4+6NO2↑+2H2O
[小结] 反应规律:
①除Au、Pt等少数金属外,硝酸几乎可能氧化所有的金属。王水(浓HNO3和浓HCl按体积比1:3配制)具有更强的氧化性,能溶解Au、Pt。
②硝酸越浓,其氧化性越强。如稀HNO3可使石蕊试变红,而浓HNO3可使石蕊试液先变红后褪色。
③一般来说,活泼金属与HNO3反应不生成H2,浓HNO3的还原产物为NO2,稀HNO3的还原产物为NO。非金属单质可被HNO3氧化为最高价氧化物或其含氧酸。活泼金属与极稀HNO3反应时,还原产物复杂,可为NO、N2O、NH4NO3等。例如:4Zn+10HNO3(稀)=4Zn(NO3)2+N20+5H2O
2HNO3(浓)+ Fe(NO3)2 === Fe(NO3)3 + NO2↑+H2O
4HNO3(稀)+ 3Fe(NO3)2 === 3Fe(NO3)3 + NO↑+2H2O
2、不稳定性
光照
[展示]一瓶呈黄色的浓硝酸
4HNO3 == 2H2O+ 4NO2↑+O2↑
[提问] 浓硝酸为什么呈黄色?硝酸应如何贮存?
[讨论]有人认为,“比较浓硝酸和稀硝酸的还原产物的化合价,浓HNO3中的氮 从+5降为+4,而稀HNO3中的氮从+5价降为+2,从化合价变化可以判断稀硝酸的氧化性比浓硝酸强。”这种看法是否正确?为什么?
[提示]从浓硝酸、稀硝酸分别与Cu反应的反应条件。剧烈程度分析。
四、硫酸和硝酸的用途
1、硝酸用途 :①重要的化工原料;②重要的化学试剂。
硝酸是一种重要的化工原料,可用于制造炸药、染料、塑料、化肥、农药、硝酸盐等;在实验室里,它是一种重要的化学试剂。
2、硫酸用途:①重要的化工原料;②重要的化学试剂。
硫酸是一种重要的化工原料,可用于制造炸药、染料、塑料、化肥、农药、精炼石油、酸洗除锈、制取挥发性酸等;在实验室里,它是一种重要的化学试剂。
[课堂练习]
1、为什么制取HCl气体用浓硫酸,而不用硝酸?
2、如何洗净一支内壁镀银的试管?
3、将石蕊试纸投入浓硝酸里,有 现象,说明浓硝酸具有 性。
4、在加入Zn粉能放出氢气的溶液中能大量共存的离子组是:
A. K+、Fe2+ 、Mg2+、 N03- B. K+、Na+ 、SO42-、 Cl-
C. CO32-、 Cl- 、I-、NH4+ D. NH4+ 、Ba2+ 、K+、0H-
5、将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时收集到气体1.12L(标准状况),则所消耗硝酸是物质的量是:
A、0.12mol B、0.11mol C、0.09mol D、0.08mol
〖知识拓展〗
1、过量计算:
若已知两种反应物的量,则需要根据化学方程式判断哪种物质过量,哪种物质不过量,然后按照不过量的物质的量进行计算。
2、多步反应计算:
若某一种物质经过两步或两步以上反应生成另一种物质,已知反应物的量,计算生成物的量,应该先找出两者之间的关系,然后进行计算。
[小结]略
[作业]课本P103页2、6题。
〖板书设计〗 三、硝酸的性质
1、氧化性
(1)与金属反应: Cu +4HN03(浓)=Cu(NO3)2 + 2NO2↑+ 2H20
3Cu +8HN03(稀) ![]() 3Cu(NO3)2 + 2NO↑+ 4H20
3Cu(NO3)2 + 2NO↑+ 4H20
(2)与非金属反应:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
S+6HNO3(浓)=H2SO4+6NO2↑+2H2O
2、不稳定性
四、硫酸和硝酸的用途
〖教后记〗
上一篇:第四节 氨硝酸 硫酸(2)
下一篇:第四章 单元复习
