第二章 化学反应与能量(知识汇总)
2015-10-19 15:31:04 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第二章 化学反应与能量(知识汇总)
一、化学能转化为热能的形式及原因
1、从化学键的角度分析
当物质发生化学反应时,断开反应物中的化学键要吸收能量,形成生成物中的化学键要放出能量。一个化学反应是放出能量还是吸收能量取决于:破坏旧键吸收的能量与形成新键放出的能量的相对大小。
2、从总能量的角度分析
一个化学反应是放出能量还是吸收能量,取决于反应物的总能量与生成物的总能量的相对大小。化学反应的过程,可以看成是能量的“贮存”或“释放”的过程。
当反应物的总能量大于生成物的总能量时,放出能量;
当反应物的总能量小于生成物的总能量时,吸收能量。
放热反应和吸热反应的能量关系图
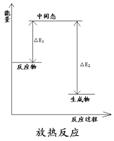

3、常见的放热反应和吸热反应
(1)常见的放热反应:
①所有的燃烧与缓慢氧化;②酸碱中和反应;③金属与酸或水反应;④大多数化合反应(特殊:C+CO2 =2CO是吸热反应)。
(2)常见的吸热反应:
①以C、H2、CO为还原剂的氧化还原反应如:C(s)+H2O(g) CO(g)+H2(g);②铵盐和碱的反应如Ba(OH)2·8H2O+NH4Cl=BaCl2+2NH3↑+10H2O;
③大多数分解反应如KClO3、KMnO4、CaCO3的分解等。
4、中和热:强酸与强碱的稀溶液发生中和反应生成1mol水,所释放出的能量,叫做中和热。
二、化学能与电能
1、火力发电:化学能间接的转化为电能。化学能→热能→机械能→电能
2、原电池
⑴概念:把化学能直接转化为电能的装置叫做原电池。
⑵原电池的工作原理:通过氧化还原反应(有电子的转移)把化学能转变为电能。
⑶原电池的组成:①活泼性不同的金属作为电极;②两个相互连接的电极插入电解质溶液;③构成闭合回路。
⑷电极名称及发生的反应:
①负极:较活泼的金属作负极,负极发生氧化反应;
②正极:较不活泼的金属或石墨作正极,正极发生还原反应;
⑸原电池正负极的判断方法:
①依据原电池两极的材料:较活泼的金属作负极;较不活泼金属或可导电非金属(石墨)、氧化物(MnO2)等作正极。
②根据(外电路)电流方向或电子流向:电流由正极流向负极;电子则由负极经外电路流向正极。
③根据原电池中的反应类型:
负极:失电子,发生氧化反应,现象通常是电极本身消耗,质量减小。
正极:得电子,发生还原反应,现象是常伴随金属的析出或H2的放出。
⑸①加快化学反应速率,如粗锌制氢气速率比纯锌制氢气快。②比较金属活动性强弱。③设计原电池。④金属的腐蚀。
3、化学电源基本类型:
①干电池:活泼金属作负极,被腐蚀或消耗。如:Cu-Zn原电池、锌锰电池。
②充电电池:两极都参加反应的原电池,可充电循环使用。如铅蓄电池等。
③燃料电池:两电极材料均为惰性电极,电极本身不发生反应,而是由引入到两极上的物质发生反应,如H2、CH4燃料电池,其电解质溶液常为碱性试剂(KOH等)。
三、化学反应速率与限度
1、化学反应的速率
⑴概念:化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。计算公式:υ=△C/△t
重要规律:以m A+n B p C+q D而言,用A、B浓度的减少或C、D浓度的增加所表示的化学反应速率之间必然存在如下关系:
VA :VB :VC :VD = m :n :c :d。
⑵影响化学反应速率的因素:
内因:由参加反应的物质的结构和性质决定的(主要因素)。
外因:外界条件对化学反应速率有一定影响
①温度:升高温度,增大速率;
②催化剂:一般加快反应速率(正催化剂)。
③浓度:增加反应物的浓度,增大速率(溶液或气体才有浓度可言)。
④压强:增大压强,增大速率(适用于有气体参加的反应)。
⑤其它因素:如光(射线)、固体的表面积(颗粒大小)、反应物的状态(溶剂)、原电池等也会改变化学反应速率。
2、化学反应的限度
⑴化学平衡状态:在一定条件下,当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度,即化学平衡状态。
化学反应的限度:一定条件下,达到化学平衡状态时化学反应所进行的程度,就叫做该化学反应的限度。
⑵化学平衡状态的特征:动、定、变。
①动:动态平衡,达到平衡状态时,正方应速率和逆反应速率相等,反应没有停止。
②定:达到平衡状态时,各组分浓度保持不变,各组成成分的含量保持一定。
③变:当条件变化时,化学反应进行程度发生变化,反应限度也发生变化。
⑶外界条件对反应限度的影响
①外界条件改变,V正>V逆,化学反应限度向着正反应程度增大的方向变化,提高反应物的转化率;
②外界条件改变,V逆>V正,化学反应限度向着逆反应程度增大的方向变化,降低反应物的转化率。
(4)判断化学反应达到平衡的方法
根据什么可以判断在一定条件下,一个任意反应:mA + nB ![]() pC + qD 是否达到化学平衡?
pC + qD 是否达到化学平衡?
判断化学反应达到平衡的标志:
①υ(正)= υ(逆) :同一物质表示的正逆反应的速率的数值相等。
②反应混合物中各组分的浓度保持不变。
(5)化学平衡的计算方法
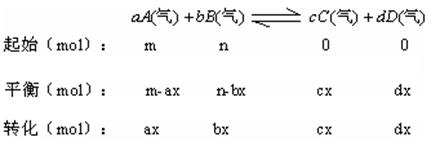

3、反应条件的控制
⑴从控制反应速率的角度:有利的反应,加快反应速率,不利的反应,减慢反应速率;
⑵从控制反应进行的程度角度:促进有利的化学反应,抑制不利的化学反应。
上一篇:第二节 化学能与电能(2)
下一篇:第三节 化学反应的速率和限度(1)
