第二节 富集在海水中的元素—氯(2)
2015-10-19 15:15:04 来源: 撰稿:董啸 摄影摄像: ; 评论:0 点击:
第二节 富集在海水中的元素—氯(2)
|
三维目标: |
|
|
|
①使学生掌握氯气与水、碱溶液反应的性质。 |
|
知识与技能: |
②了解常见漂白剂的漂白原理。 |
|
|
③使学生掌握氯离子的检验方法。 |
|
过程与方法: |
①探究氯气的性质和用途。 |
|
|
②通过探究掌握氯离子的检验方法。 |
|
情感、态度 |
①使学生形成勇于创新的习惯,培养创新能力。 |
|
与价值观 |
②通过对氯气两面性的学习,培养辩证唯物主义观点。 |
|
教学重点: |
氯气与碱反应、氯离子的检验方法 |
|
教学难点: |
氯气与碱反应 |
|
教学方法: |
分析比较法和实验探究法结合 |
|
教学准备: |
多媒体课件 |
|
教学过程: |
第二课时 |
[复习提问]灼热的铁丝伸入盛有氯气的集气瓶里,有何现象?写出反应的化学方程式。
[引入]打开自来水龙头,会闻到一股刺激性的气味,你想过什么原因么?
[分析]氯气溶解于水,所得的水溶液叫氯水。溶解的氯,部分以游离态存在,部分与水发生反应。
(3)氯气与水反应:
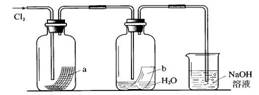 Cl2+H2O = HClO+HCl (HClO:次氯酸)
Cl2+H2O = HClO+HCl (HClO:次氯酸)
[实验4-4、4-5]
[探究与交流]Cl2可以使湿润的有色布条褪色,不能使干燥的有色布条褪色,这个事实说明什么?
[结论]起漂白作用的不是氯气,而是氯气与水反应生成的次氯酸。
[小资料]次氯酸的性质:
次氯酸是一种弱酸,不稳定见光易分解,是一种强氧化剂、杀菌剂、漂白剂。
2HClO ![]() 2HCl+O2↑
2HCl+O2↑
次氯酸是一种强氧化剂能杀死水里的病菌,自来水常用氯气杀菌消毒,就是因为氯气溶于水产生次氯酸,次氯酸起杀菌作用。次氯酸可用作漂白剂,因为它能使染料和有机色质氧化而褪色。
【讨论题】向酚酞溶液中加入过氧化钠的现象是什么?氯气与湿润的湿润的蓝色石蕊试纸做用后现象如何?
[过渡]由于氯气和水反应时生成酸,所以氯水可以和碱液反应。
(4)与碱液反应:
Cl2+2NaOH = NaCl+NaClO+H2O
2Cl2+2Ca(OH)2 = Ca(ClO)2+CaCl2+2H2O
[思考与交流](1)久置氯水与新置氯水有何区别? 氯水漂白和杀菌的缺点是什么?如何解决?
[结论]①新制取的氯水中含有Cl2、HClO、H2O、H+、Cl—、ClO—;久置的氯水因为HClO分解,所以含有 H2O 、H+、Cl—。
②直接用氯气做漂白剂,但因氯气不稳定溶解度小难以保存,使用起来很不方便。氯气对自来水消毒时,氯气与水中的有机物发生反应生成有机氯化物,对人体有害。
③可以使用漂白液、漂白粉、漂白精等代替氯水进行漂白。也可以用二氧化氯(ClO2)、臭氧O3代替氯气对自来水消毒。
(2)漂白液、漂白粉、漂白精的生产原理什么?漂白液、漂白粉和漂粉精的有效成分是什么?漂白原理又是什么?存放漂粉精时应注意哪些问题?
[结论] ①漂白液、漂白粉和漂粉精的生产原理是氯气与碱发生反应;
②漂白液(有效成分:NaClO);漂白粉 (主要成分:Ca(ClO)2、CaCl2,有效成分Ca(ClO)2);漂粉精(主要成分:Ca(ClO)2,有效成分Ca(ClO)2)。
③漂白原理是漂白液、漂白粉和漂粉精中的有效成分与酸反应生成次氯酸。
Ca(ClO)2+2HCl=CaCl2+2HClO;Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO
④密封保存,防止与空气接触。
(3)氯气可以杀菌消毒漂白,对人类社会做出巨大的贡献,但是氯气有毒,使用不好可能带来环境污染,危害人体健康。科学家已经找到可以代替氯气的消毒剂。对此,你有何认识?对你有什么启示?
①任何事物都有两面性;正确使用是关键。
②科学发展有局限性,科学技术在发展中不断发展完善,不断进步。
[小资料] 用氯气对饮用水消毒会产生使人致癌的有机氯,世界环保联盟已全面禁止用氯气对饮用水消毒,建议采用广谱高效消毒剂二氧化氯(ClO2)。二氧化氯是无色或微黄色透明液体,是近年来国内外研究开发的一种新型的广谱、安全、快速、高效氧化消毒剂。
[板书]二、氯离子(Cl-)的检验
[实验4-6]检验盐酸、NaCl溶液中的Cl-,并用Na2CO3溶液做对比实验,并填表。
(1)步骤:先加几滴硝酸银溶液,再加几滴稀硝酸,出现不溶于稀硝酸的白色沉淀,说明溶液中有氯离子(Cl-)。
(2)离子反应:
Ag+ + Cl- = AgCl↓ 2Ag+ + CO32- = Ag2CO3↓
Ag2CO3+2H+ = 2Ag++CO2↑+H2O
[思考]为什么检验Cl-时,先加几滴硝酸银溶液,还要再加几滴稀硝酸?
【知识拓展】
1、氯气的实验室制法
(1)实验室制氯气的实验原理:MnO2+4HCl(浓)△ MnCl2+Cl2↑+2H2O
(2)实验装置:固体与液体加热制取气体。
(3)氯气的收集方法:实验室收集氯气应该用向上排空气法收集,但是不能用排水法收集。可以使用排饱和食盐水法收集氯气。
除杂方法:将氯气通过装有饱和食盐水的洗气瓶;
干燥方法:将氯气通过装有浓硫酸的洗气瓶。
(4)氯气的检验:湿润的蓝色石蕊试纸、湿润的碘化钾淀粉试纸
(5)尾气处理:氯气可以用氢氧化钠溶液吸收。
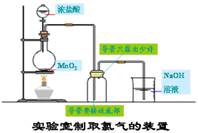
(6)制备气体的基本步骤:
实验室制备气体一般按以下步骤进行:①连接仪器,②检查气密性,③加装药品,④开始反应,⑤收集气体,⑥停止反应,⑦拆洗仪器。
2、卤素
(1)卤素的原子结构:
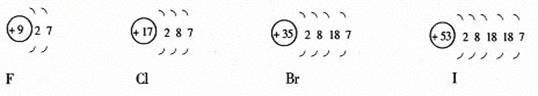
(2)卤素原子结构的比较:
相同点:最外层均有7个电子。
不同点:由氟到碘核电荷数依次递增,电子层数依次增多,原子半径依次增大。
(3)卤素的化学性与结构的关系:
从氟到碘,最外层电子数相同,应具有相似的化学性质,即可以得一个电子使最外层达到8电子的稳定结构,因此,化学性质都很活泼,都具有氧化性;但由于原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,得电子能力逐渐减弱,即氧化性逐渐减弱。
氧化性:F2>Cl2>Br2>I2 还原性:F-<Cl-<Br-<I-
2NaI + Cl2 = 2NaCl + I2 2NaI+ Br2 = 2NaBr + I2
[小结]略
[作业]P87 5、7
〖板书设计〗 第二课时
(3)氯气与水反应:Cl2+H2O = HClO+HCl (HClO:次氯酸)
(4)与碱液反应:Cl2+2NaOH = NaCl+NaClO+H2O
二、氯离子(Cl-)的检验
(1)步骤 (2)离子反应
〖教后记〗
上一篇:第二节 富集在海水中的元素—氯(1)
下一篇:第三节 硫和氮的氧化物(1)
